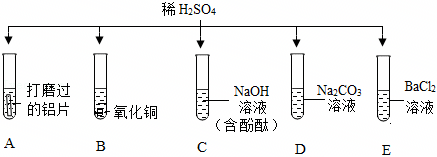
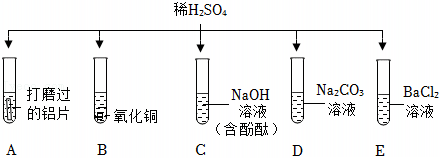
[解析]
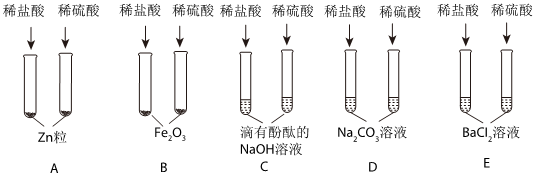
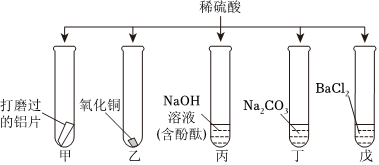
解:(1)E中硫酸与氯化钡反应生成硫酸钡和盐酸,该过程中氢离子没有参与反应,没有体现出酸的化学通性。
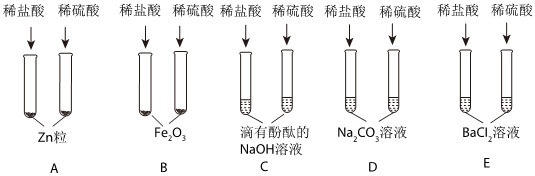
(2)铝在常温下能与氧气反应生成致密的氧化铝膜,所以将铝片和盐酸混合后,开始稀盐酸先和氧化铝反应生成氯化铝和水,过一段时间,稀盐酸再和铝反应生成氯化铝和氢气,过一会儿才看到气泡。
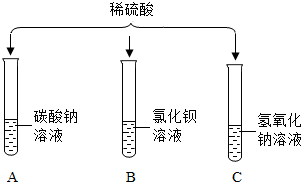
(3)硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,观察到有气泡产生,氢氧化钠与硫酸反应生成硫酸钠和水,无明显现象,碳酸钠溶液显碱性,向该试管中滴加紫色石蕊试液,溶液变蓝,则该溶液为碳酸钠溶液,反应的化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑。
(4)A、向反应后的溶液中滴加无色酚酞溶液,无色酚酞溶液不变红,说明溶液中没有氢氧化钠,即氢氧化钠已反应,故A符合题意;
B、向反应后的溶液中滴加足量的硝酸钡溶液,产生白色沉淀,说明溶液中含有硫酸根离子,不能确定是否发生反应,故B不符合题意;
C、向反应后的溶液中滴加少量的氯化铝溶液,氢氧化钠能与氯化铝反应生成氢氧化铝和氯化钠。无明显现象,说明溶液中没有氢氧化钠,即氢氧化钠已反应,故C符合题意。
(5)反应结束后将BC试管中所有物质混合,观察到过一会儿产生蓝色沉淀,氢氧化钠先与硫酸反应生成硫酸钠和水,再与硫酸铜反应生成氢氧化铜和硫酸钠,静置后上层溶液为无色,说明溶液中没有硫酸铜,一定含有硫酸钠,可能含有氢氧化钠。
A、二氧化碳与氢氧化钠反应生成碳酸钠和水,无明显现象,故A不符合题意;
B、氢氧化钠能使无色酚酞溶液变红,通过无色酚酞颜色是否变化,可知是否含有氢氧化钠,故B符合题意;
C、氯化钡与硫酸钠反应生成硫酸钡白色沉淀和氯化钠,不能证是否含有氢氧化钠,故C不符合题意;
D、氢氧化钠与硝酸铁反应生成氢氧化铁红褐色沉淀和硝酸钠,有明显现象,可验证是否含有氢氧化钠,故D符合题意。
故答案为:(1)E。
(2)未打磨铝表面的致密氧化膜。
(3)H2SO4+Na2CO3=Na2SO4+H2O+CO2↑。
(4)AC。
(5)BD。
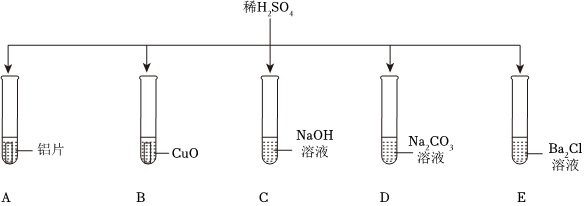
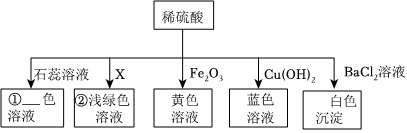
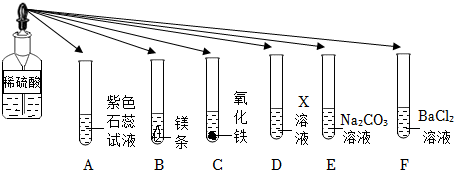
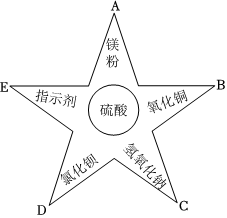 小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。
小乐同学复习酸的化学性质时,构建了硫酸的“五角星图”,其中五个顶角表示能与硫酸发生化学反应的五类物质。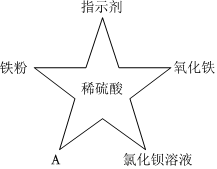 五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。
五星红旗闪耀奥运赛场,小王同学复习酸的化学性质时构建了硫酸“五角星图”,其中五个顶角表示与硫酸发生化学反应的五种不同类别的物质。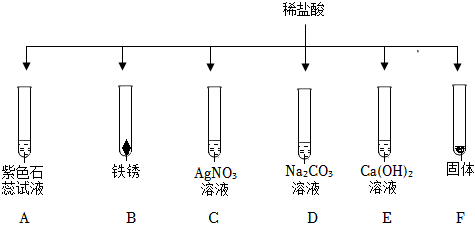
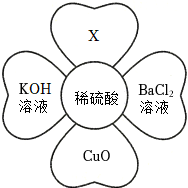 如图所示,稀硫酸能与相连的物质发生化学反应。
如图所示,稀硫酸能与相连的物质发生化学反应。