服务热线
搜题▪组卷
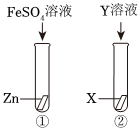 中国已成为世界上最大的矿产品生产国,其中铁、铅、锌、铜等金属矿的储量均居世界前列。
中国已成为世界上最大的矿产品生产国,其中铁、铅、锌、铜等金属矿的储量均居世界前列。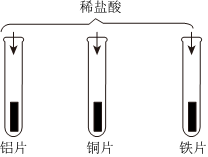 “神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。
“神舟飞天”、“高铁奔驰”等中国制造,展现了中国智慧,增强了中华民族的自信心和自豪感,根据所学知识回答问题。
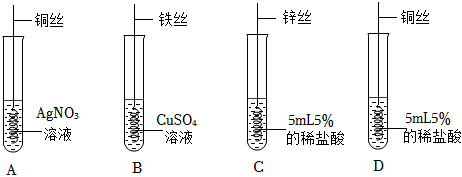
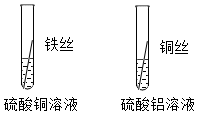
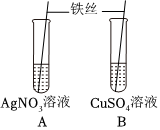 铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。
铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。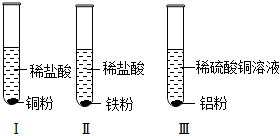
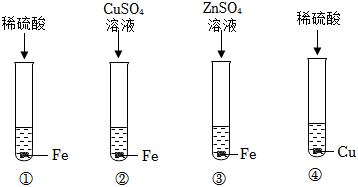
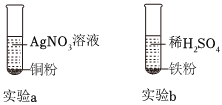 三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题:
三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题: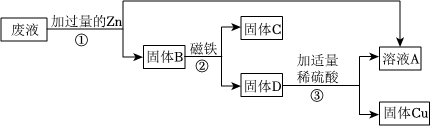
 铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验:
铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验: 实验中一个能发生反应的化学方程式 。
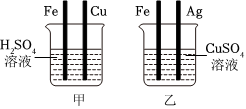
实验中一个能发生反应的化学方程式 。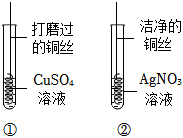 根据金属的性质回答下列问题。
根据金属的性质回答下列问题。
ybw@dyw.com
2025-04-14
初中化学 | | 填空题