[考点]
实验步骤的探究,金属的化学性质,金属的回收利用及其重要性,书写化学方程式、文字表达式、电离方程式,
[答案]
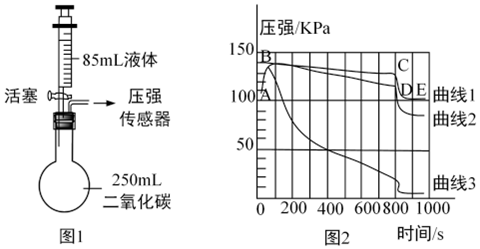
(1)过滤;
(2)Al2(SO4)3、H2SO4;
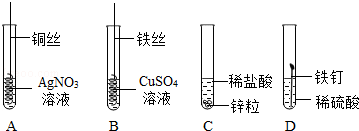
(3)Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)节约有限的金属资源。
[解析]
解:(1)过滤可以将不溶性固体从溶液中分离出来,所以步骤Ⅰ和步骤Ⅱ都涉及的实验操作是:过滤;
(2)步骤Ⅰ中加入足量稀硫酸后发生的反应是铝和硫酸反应生成硫酸铝和氢气,步骤Ⅰ后所得溶液中的溶质是Al2(SO4)3和过量的H2SO4;
(3)步骤Ⅱ中加入适量硝酸银中,铜能与硝酸银溶液反应生成硝酸铜溶液和银,反应的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)金属资源属于不可再生资源,节约、回收再利用金属具有重要意义,回收利用废旧金属制品的目的之一是节约有限的金属资源。
故答案为:(1)过滤;
(2)Al2(SO4)3、H2SO4;
(3)Cu+2AgNO3=Cu(NO3)2+2Ag;
(4)节约有限的金属资源。
[点评]
本题考查了"实验步骤的探究,金属的化学性质,金属的回收利用及其重要性,书写化学方程式、文字表达式、电离方程式,",属于"综合题",熟悉题型是解题的关键。

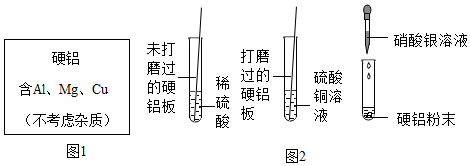
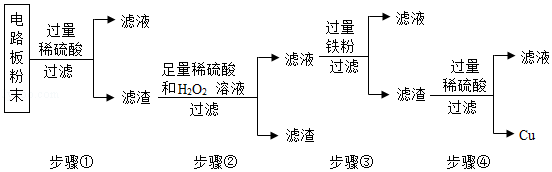
 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。 (1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。
(1)空易拉罐应放入 (选填可回收物或其它垃圾)筒中。