[考点]
固体溶解度曲线及其作用,利用溶解度曲线判断混合物分离提纯的方法,
[答案]
(1)不饱和;
(2)降温结晶;
(3)8;
(4)<。
[解析]
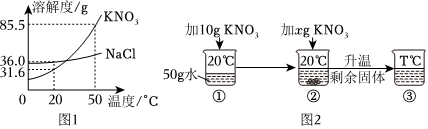
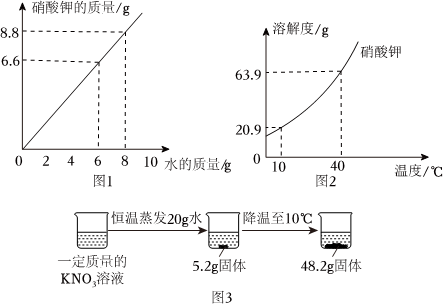
解:(1)20℃时,氯化钠的溶解度是36g,即在该温度下,100g水中最多溶解36g,所以将17gNaCl固体加入50g水中充分溶解,得到的NaCl溶液是不饱和溶液;
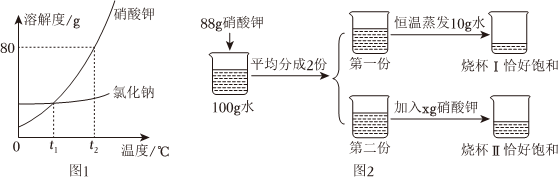
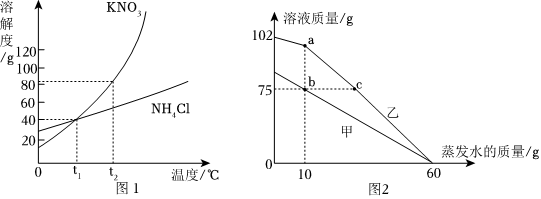
(2)硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以当KNO3中混有少量的NaCl,可采用降温结晶的方法提纯KNO3;
(3)20℃时,KNO3的溶解度是36.0g,所以该温度下,50g水中最多溶解18g,所以先向50g水中加入10gKNO3,还需要加入8g,刚好达到饱和,所以当x=8时,②中恰好形成饱和溶液且没有固体剩余;
(4)将50℃KNO3和NaCl的饱和溶液同时降温至20℃时,都会析出晶体,都属于饱和溶液,饱和溶液的溶质质量分数大小与溶解度有关,即在20℃时,谁的溶解度大,谁的饱和溶液溶质质量分数大,所以将50℃KNO3和NaCl的饱和溶液同时降温至20℃时,所得溶液溶质质量分数大小关系为:KNO3<NaCl。
故答案为:(1)不饱和;
(2)降温结晶;
(3)8;
(4)<。
[点评]
本题考查了"固体溶解度曲线及其作用,利用溶解度曲线判断混合物分离提纯的方法,",属于"易错题",熟悉题型是解题的关键。

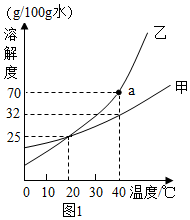
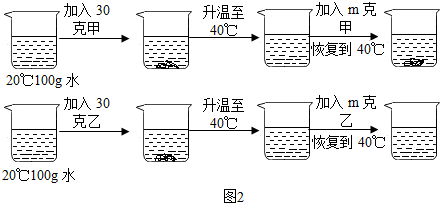
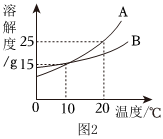
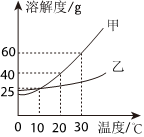 如图是甲、乙两种固体物质的溶解度曲线。据图回答:
如图是甲、乙两种固体物质的溶解度曲线。据图回答: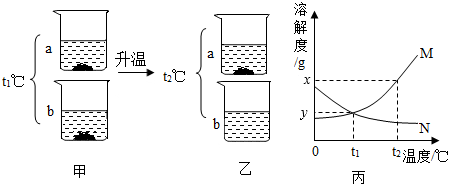
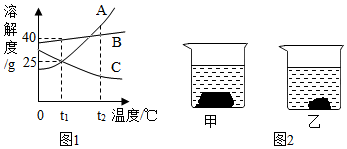
 甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题: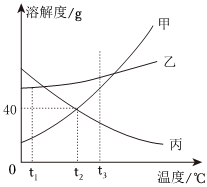 如图,依据甲、乙、丙三种物质的溶解度曲线,回答下列问题:
如图,依据甲、乙、丙三种物质的溶解度曲线,回答下列问题: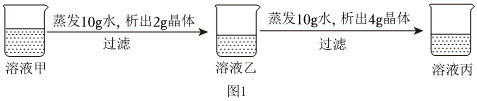
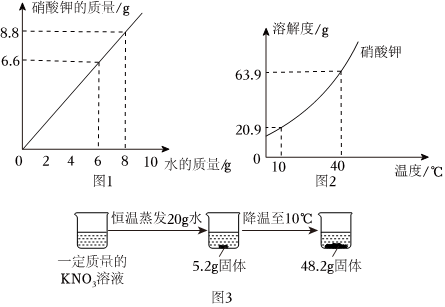
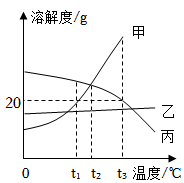
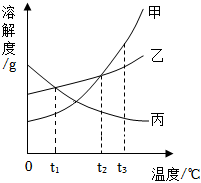 如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答下列问题。
如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答下列问题。