[考点]
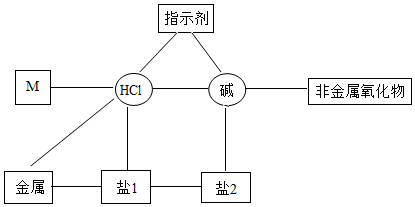
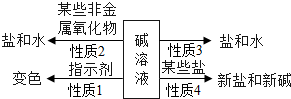
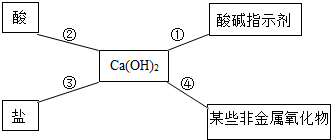
酸碱指示剂及其性质,碱的化学性质,中和反应及其应用,
[答案]
(1)OH﹣;
(2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)B。
[解析]
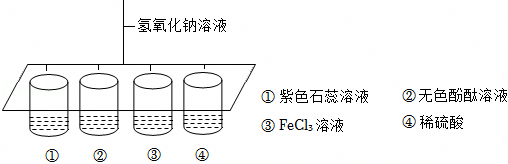
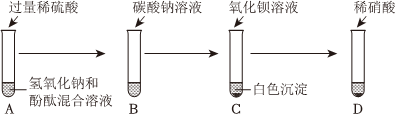
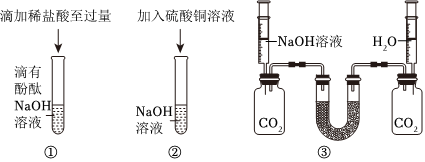
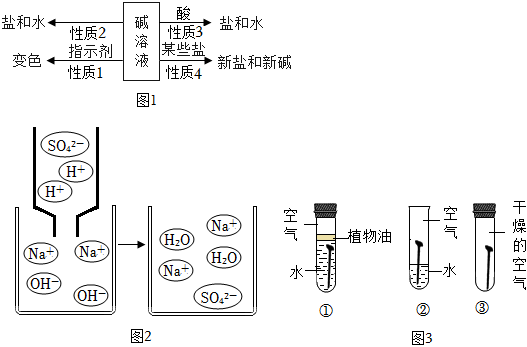
解:(1)将氢氧化钠滴入紫色石蕊溶液中,溶液变蓝色,滴入无色酚酞溶液中,溶液变为红色,使石蕊、酚酞变色的是氢氧化钠溶液中的OH﹣;
(2)实验③中氢氧化钠和氯化铁反应生成氢氧化铁和氯化钠,反应的化学方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)A、若先向稀硫酸中加入酚酞溶液;再逐滴加入少量NaOH溶液,溶液不变色,说明滴入的氢氧化钠消失,说明氢氧化钠和硫酸发生了反应,故选项说法错误;
B、2NaOH+H2SO4=Na2SO4+2H2O若恰好完全反应,溶液为硫酸钠溶液,则反应后溶液中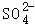 和Na+的个数比为1:2,故选项说法正确;
C、向反应后的溶液中加入碳酸钾溶液,无明显现象,不能说明两种物质恰好完全反应,也可能溶液呈碱性,氢氧化钠溶液有剩余,故选项说法错误;
D、硫酸钠、硫酸均能与硝酸钡反应生成不溶于酸的硫酸钡沉淀,不能说明酸过量,故选项说法错误。
故答案为:
(1)OH﹣;
(2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)B。
和Na+的个数比为1:2,故选项说法正确;
C、向反应后的溶液中加入碳酸钾溶液,无明显现象,不能说明两种物质恰好完全反应,也可能溶液呈碱性,氢氧化钠溶液有剩余,故选项说法错误;
D、硫酸钠、硫酸均能与硝酸钡反应生成不溶于酸的硫酸钡沉淀,不能说明酸过量,故选项说法错误。
故答案为:
(1)OH﹣;
(2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
(3)B。
[点评]
本题考查了"酸碱指示剂及其性质,碱的化学性质,中和反应及其应用,",属于"难典题",熟悉题型是解题的关键。