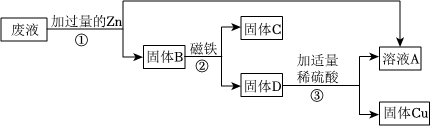
[答案]
(1)除去金属表面的氧化膜;
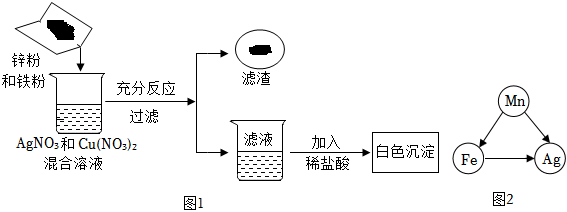
(2)X>Zn>Cu;
(3)Zn+H2SO4=ZnSO4+H2↑;
(4)CuSO4或CuCl2或Cu(NO3)2。
[解析]
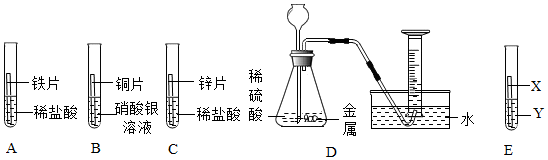
解:(1)实验前Zn、X、Cu均要使用砂纸打磨,目的是除去金属表面的氧化膜;
(2)由图可知,实验过程中,Zn、X能与稀硫酸反应,X与稀硫酸的反应比Zn的反应剧烈,Cu不与稀硫酸反应,则Zn、X、Cu三种金属的活动性强弱顺序为X>Zn>Cu;
(3)甲烧杯中锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式Zn+H2SO4=ZnSO4+H2↑;
(4)将上述实验中的金属X更换为Ag,要验证Zn、Ag、Cu的金属活动性顺序,可以利用“三取中”的实验方法,已经有了金属的单质,可以可将上图烧杯中的稀硫酸更换为CuSO4、CuCl2或Cu(NO3)2溶液。
故答案为:
(1)除去金属表面的氧化膜;
(2)X>Zn>Cu;
(3)Zn+H2SO4=ZnSO4+H2↑;
(4)CuSO4或CuCl2或Cu(NO3)2。
[点评]
本题考查了"金属活动性强弱的判断,",属于"基础题",熟悉题型是解题的关键。
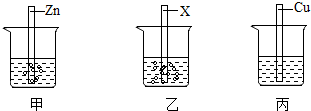
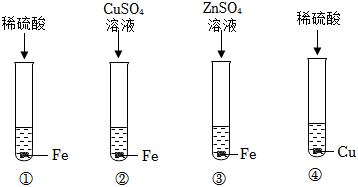
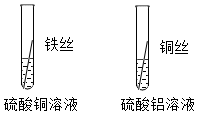
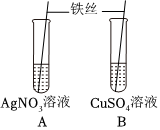 铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。
铁是生活中常见的金属,某同学用打磨过的铁丝进行如图实验。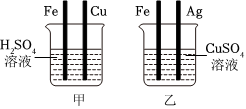

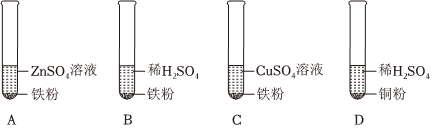
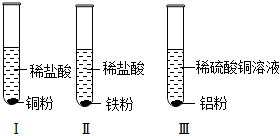
 铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验:
铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀硫酸、硫酸铜溶液、硫酸铝溶液,做了以下实验: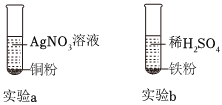 三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题:
三星堆是中华文明的瑰宝,出土了大量的青铜器文物。回答下列问题: