服务热线
搜题▪组卷
 ?
?| 实验编号 | a | b | c | d |
| 加入KNO3固体的质量/g | 45 | 50 | 55 | 60 |
| 所得溶液的质量/g | 95 | 100 | 105 | 105 |
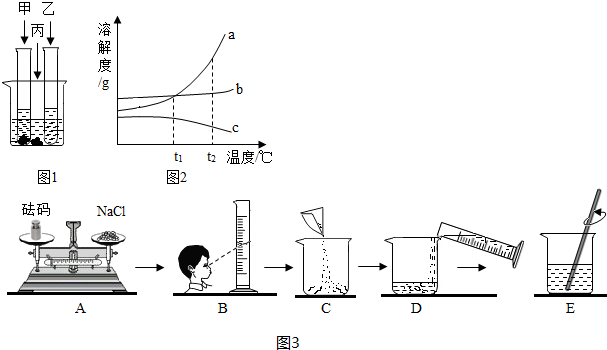
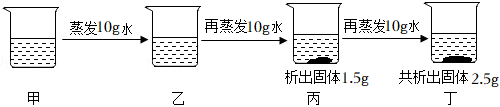
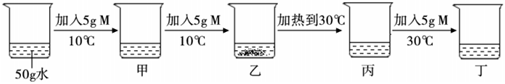
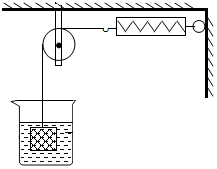 如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):
如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):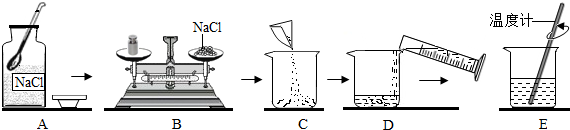
 ?
?
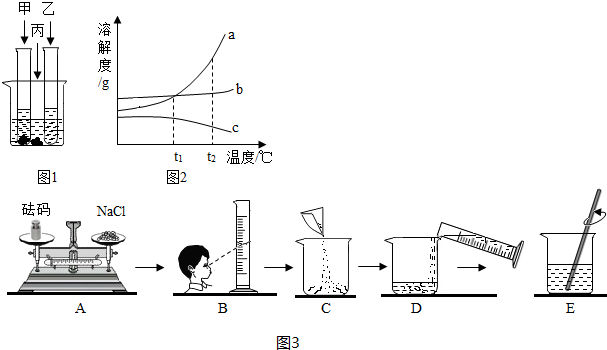
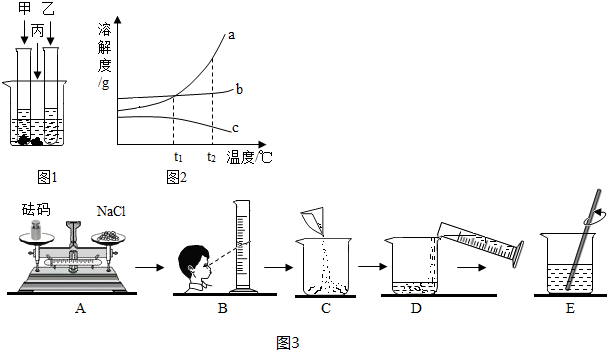
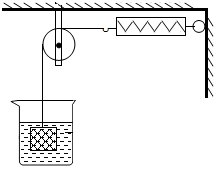 如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):
如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):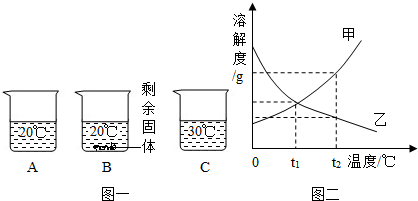
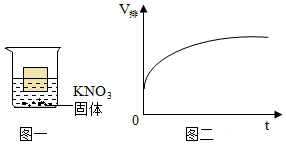
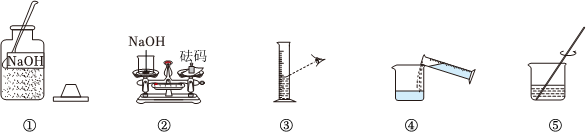
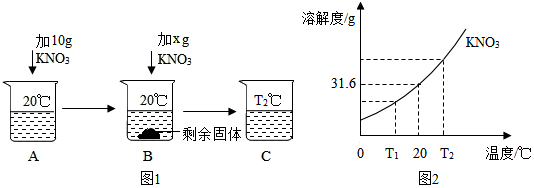
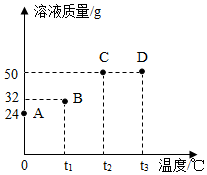 将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。
将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。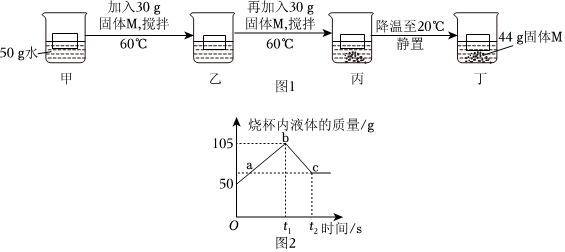

wsx@dyw.com
2024-02-04
初中化学 | 九年级上 | 填空题