服务热线
搜题▪组卷
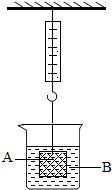
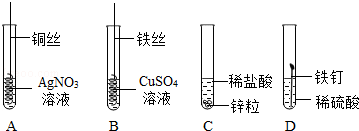
 化学变化中常随着美丽的现象,镁条在空气中燃烧时发出 ,放出大量的热,生成白色粉末状固体,镁燃烧的化学方程式 ,铜在空气中加热表面变黑,用化学方程式表示发生的化学反应 。如图实验中观察到的现象是 。
化学变化中常随着美丽的现象,镁条在空气中燃烧时发出 ,放出大量的热,生成白色粉末状固体,镁燃烧的化学方程式 ,铜在空气中加热表面变黑,用化学方程式表示发生的化学反应 。如图实验中观察到的现象是 。
 金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。
金属的利用史成就卓越,是劳动人民生产与生活智慧的结晶。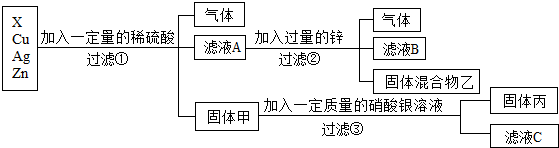
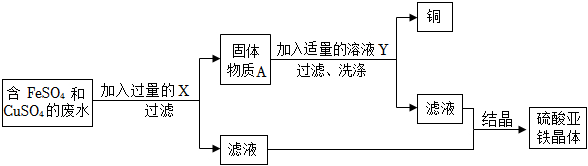
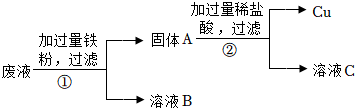 生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)
生产线路板的废液中含有FeCl3、FeCl2、CuCl2。化学兴趣小组的同学在实验室利用如图所示流程进行从废液中回收金属铜的实验。(已知:2FeCl3+Fe=3FeCl2)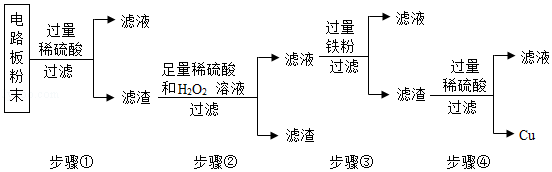
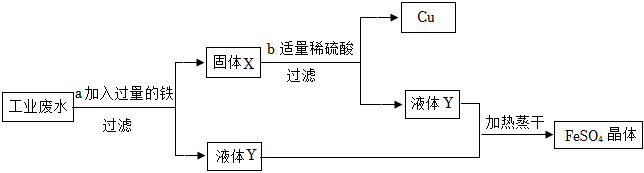
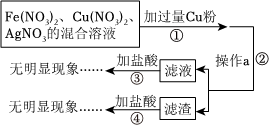 化学学习小组对某工业废水进行实验探究,部分过程如图,请回答下列问题:
化学学习小组对某工业废水进行实验探究,部分过程如图,请回答下列问题: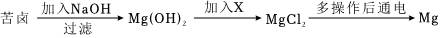

zki@dyw.com
2024-03-01
初中化学 | | 填空题