服务热线
搜题▪组卷
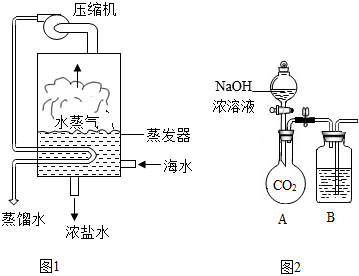
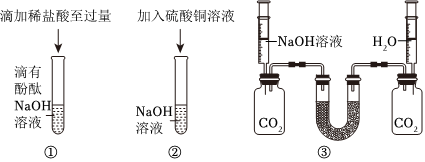
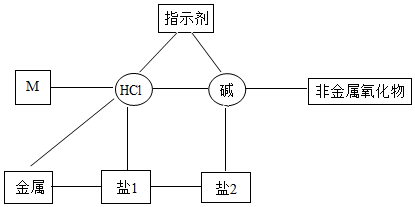
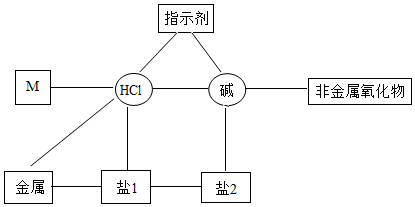
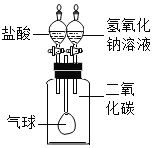
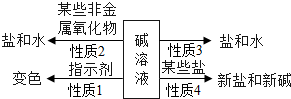
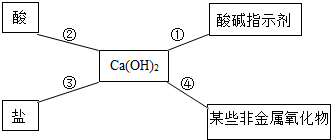
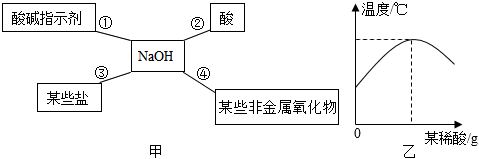
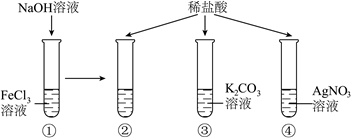
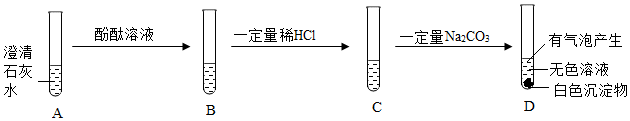
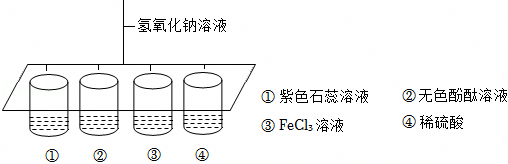
 陕南盛产茶叶,茶文化源远流长。为了了解茶叶的组成和作用,学习小组的同学查得某茶叶样品的成分及含量如图所示:
陕南盛产茶叶,茶文化源远流长。为了了解茶叶的组成和作用,学习小组的同学查得某茶叶样品的成分及含量如图所示:

lg@dyw.com
2021-11-11
初中化学 | 九年级上 | 填空题