[考点]
实验探究物质的性质或变化规律,溶液的酸碱度测定,金属活动性顺序及其应用,碱的化学性质,书写化学方程式、文字表达式、电离方程式,
[解析]
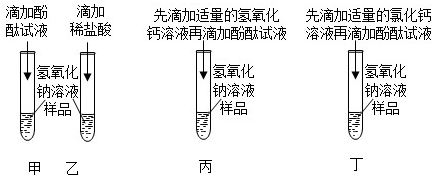
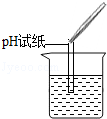
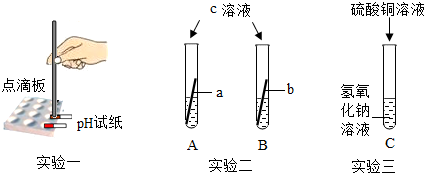
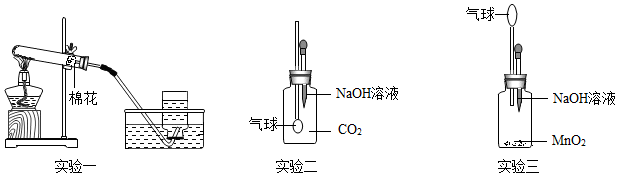
解:(1)实验一:用pH试纸测得pH<7,则说明硫酸铜溶液呈酸性;pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
实验二:铁与硫酸铜反应生成硫酸亚铁和铜,铁表面会附着红色物质,溶液逐渐由蓝色变为浅绿色,因为生成的硫酸亚铁的溶液呈浅绿色所以随着反应的进行溶液逐渐变为浅绿色.证明铁的活动性大于铜,而试管B中无明显现象,证明银的活动性小于铜;则a、b、c分别为铁、银、硫酸铜溶液;所以三种金属活动性由强到弱的顺序依次是铁>铜>银;
实验三:硫酸铜与氢氧化钠反应生成硫酸钠和氢氧化铜,方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
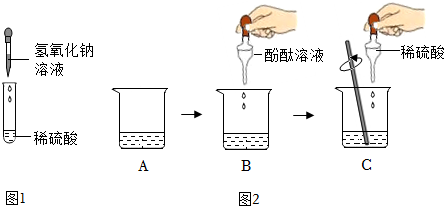
(2)【猜想假设】硫酸铜与氢氧化钠恰好反应,滤液中溶质为Na2SO4.如果硫酸铜过量,滤液中溶质为Na2SO4和CuSO4;如果氢氧化钠过量,滤液中溶质为Na2SO4和NaOH.又因为无色滤液,所以硫酸铜不可能过量.
【实验验证】向其中滴加几滴无色酚酞溶液,溶液为无色,说明不含NaOH,所以滤液中溶质为Na2SO4.
【拓展迁移】氢氧化铜与硫酸反应生成硫酸铜和水.
故答案为:(1)实验一:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
实验二:Fe、Ag、CuSO4;铁表面会附着红色物质,溶液逐渐由蓝色变为浅绿色;而试管B中无明显现象;
实验三:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4.
(2)【猜想假设】两;
【实验验证】Na2SO4和NaOH或Na2SO4.
【拓展迁移】稀硫酸.
[点评]
本题考查了"实验探究物质的性质或变化规律,溶液的酸碱度测定,金属活动性顺序及其应用,碱的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"压轴题",熟悉题型是解题的关键。
 在一次化学兴趣小组活动中,老师拿来一瓶标签有破损的试剂瓶,如图,里面盛有一种无色溶液。该化学兴趣小组的同学对此展开探究:
在一次化学兴趣小组活动中,老师拿来一瓶标签有破损的试剂瓶,如图,里面盛有一种无色溶液。该化学兴趣小组的同学对此展开探究:
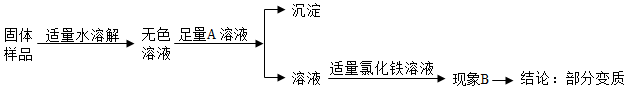
 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过询问老师后知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断是否变质,化学小组的同学进行了如下的探究活动:
实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过询问老师后知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断是否变质,化学小组的同学进行了如下的探究活动:
 化学实验课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图):
化学实验课上,老师拿来一瓶标签有破损的试剂瓶,里面盛有一种无色溶液(如图):

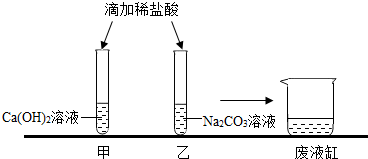 实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。