服务热线
搜题▪组卷
A.t1℃时,三种物质的溶解度大小关系:乙>甲=丙
B.t2℃时,若三种物质的饱和溶液质量相等,则溶液中水的质量:甲=乙>丙
C.t3℃时,饱和甲溶液中溶质与溶剂的质量比为4:5
D.t3℃时,三种物质的饱和溶液中,溶质质量分数最小的是丙
A.t℃时,KNO3和NaCl的溶解度相等
B.如图2向试管中加水,烧杯中的硝酸钾固体会继续溶解
C.60℃时,将60gKNO3固体加入50g水中充分溶解,得到110g的KNO3溶液
D.将60℃时KNO3和NaCl的饱和溶液降温至t℃所得溶液的溶质质量分数相等
A.t℃时,KNO3和NaCl的溶解度相等
B.如图2向试管中加水,烧杯中的硝酸钾固体会继续溶解
C.60℃时,将60gKNO3固体加入50g水中充分溶解,得到110g的KNO3溶液
D.将60℃时KNO3和NaCl的饱和溶液降温至t℃所得溶液的溶质质量分数相等
A.P点表示t1℃时,a、c两种物质的溶解度相等
B.将c的饱和溶液变为不饱和溶液,可采用降温的方法
C.t2℃时,将30g?a物质加入到50g水中充分搅拌,得到75g?a的饱和溶液
D.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
A.三种物质的溶解度氯化镁>硫酸镁>氯化钠
B.三种物质的溶解度都随温度的升高而增大
C.向卤水中滴加硝酸银溶液可以检验是否存在氯化镁
D.将60℃时的硫酸镁和氯化钠两种物质的饱和溶液分别降温至a℃,所得溶液溶质质量分数相等
A.甲的溶解度大于乙
B.t1℃时,甲、乙饱和溶液中溶质质量相等
C.将t2℃的甲、乙饱和溶液降温至t1℃时,析出固体质量甲大于乙
D.将t1℃的甲、乙饱和溶液升温至t2℃时,所得溶液中溶质的质量分数相等
A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.MgSO4的饱和溶液在t2℃时,溶质的质量分数最大
C.t1℃~t3℃,MgSO4的溶解度随温度升高而增大
D.t3℃时的MgSO4饱和溶液降温至t2℃时,有晶体析出
A.P点表示t1℃时,a、c两种物质的溶解度相等
B.将c的饱和溶液变为不饱和溶液,可采用降温的方法
C.t2℃时,将30g?a物质加入到50g水中充分搅拌,得到75g?a的饱和溶液
D.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
A.t℃时,KNO3溶液和NH4Cl溶液的浓度一定相同
B.20℃时,可配制溶质质量分数为28%的NH4Cl溶液
C.采用蒸发结晶的方法除去NH4Cl中混有的少量KNO3
D.分别将等质量的50℃的KNO3、NH4Cl溶液降温到20℃,析出KNO3的质量大于NH4Cl的质量
A.原饱和溶液中,所含溶质的质量a>b=c
B.恢复至t2℃时,所得溶液的溶质质量分数a>b=c
C.恢复至t2℃时,三种溶液一定都是饱和溶液
D.若继续降温至t1℃,三种溶液一定都是不饱和溶液
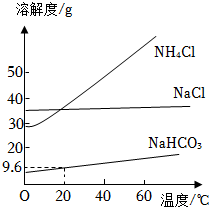 “侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线,下列叙述正确的是( )
“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是NaCl+NH4HCO3=NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线,下列叙述正确的是( )
A.20℃时,将9.6gNaHCO3加入到90.4g水中,可得到100g饱和溶液
B.20℃时NH4Cl和NaCl的溶解度相等
C.NH4Cl溶液从40℃降温至20℃时,一定有晶体析出
D.分别将60℃时的NH4Cl和NaHCO3的饱和溶液降温至20℃时,溶质质量分数为NH4Cl<NaHCO3
A.升温10℃后,M点延曲线向右上移
B.降温10℃后,M点延曲线向左下移
C.降温10℃后,N点向左平移
D.恒温蒸发溶剂时,M点不动,N点向上移动至曲线后不再变化
A.MnSO4的溶解度随温度升高先增后减
B.a点溶液升温可得不饱和溶液
C.40℃时50g水中溶解30gMnSO4得b点溶液
D.c点溶液降温至20℃可得MnSO4晶体
A.甲物质的溶解度大于乙物质的溶解度
B.甲中含有少量的乙,可以用蒸发溶剂的方法提纯乙
C.t2℃时,将等质量的甲、乙两种物质的溶液分别降温至t1℃,析出晶体的质量甲一定大于乙
D.t2℃时,乙饱和溶液中溶质的质量分数一定小于甲饱和溶液中溶质的质量分数
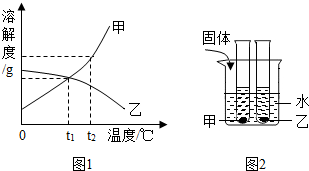
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水中加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出

mz@dyw.com
2016-04-07
初中化学 | | 选择题