[考点]
实验探究物质的组成成分以及含量,固体物质的溶解,过滤所需的仪器,蒸发,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,
[答案]
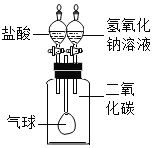
【提出猜想】二CO2+2NaOH=Na2CO3+H2O。
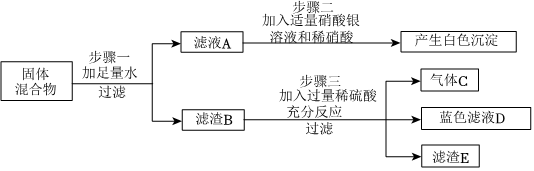
【实验探究1】(1)足量氯化钙溶液;Na2CO3+CaCl2=CaCO3↓+2NaCl。
(2)酚酞溶液;溶液变红。
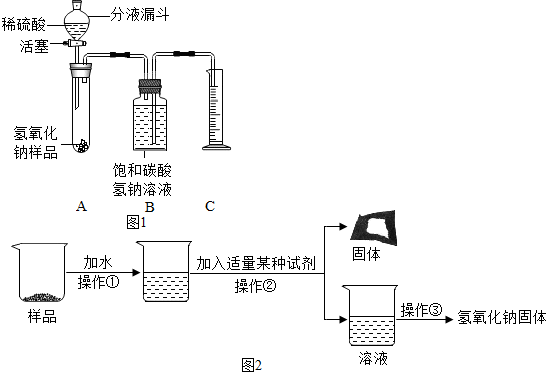
【实验探究2】(1)检查装置气密性。
(2)二氧化碳能溶于水,且与水反应。
(3)没有。
(4)47.7%。
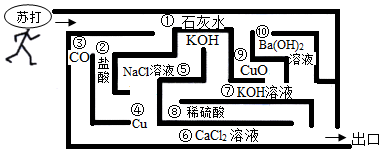
【实验探究3】(1)溶解、过滤、蒸发结晶;玻璃棒。
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(3)大于。
【实验反思】(1)①②④⑤⑥。
(2)实验探究1证明含有碳酸钠,实验探究3去除碳酸钠。
[解析]
解:【提出猜想】二氧化碳与氢氧化钠反应生成碳酸钠和水,书写化学方程式注意配平,所以化学方程式为CO2+2NaOH=Na2CO3+H2O;
故答案为:CO2+2NaOH=Na2CO3+H2O。
【实验探究1】(1)猜想二成立,说明含有碳酸钠和氢氧化钠,碳酸钠可与氯化钙反应生成碳酸钙沉淀和氯化钠,因此看到白色沉淀产生,加入氯化钙也不影响溶液pH,同时为了确保碳酸钠全部去除,需要加入足量的氯化钙溶液;书写化学方程式注意配平及沉淀符号,所以化学方程式为Na2CO3+CaCl2=CaCO3↓+2NaCl;
故答案为:足量氯化钙溶液;Na2CO3+CaCl2=CaCO3↓+2NaCl。
(2)滤液中若含有氢氧化钠,加入酚酞后,溶液变为红色,证明含有氢氧化钠;
故答案为:酚酞溶液;溶液变红。
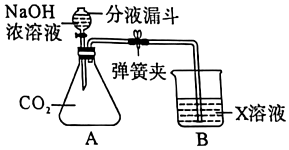
【实验探究2】(1)需要通过气体测量,因此需要保证装置气密性;
故答案为:检查装置气密性。
(2)二氧化碳能溶于水,且可与水反应,这样造成二氧化碳检测结果偏小,引起误差;
故答案为:二氧化碳能溶于水,且与水反应。
(3)内部压强变化是气体体积改变引起,通入多少二氧化碳就相应发生多大压强变化,因此内部残留的气体对实验结果没有影响;
故答案为:没有。
(4)排出220mL饱和碳酸氢钠溶液,说明二氧化碳体积为220mL即0.22L,所以二氧化碳质量=0.22L×1.8g/L=0.396g,设碳酸钠质量为m,
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
106 44
m 0.396g
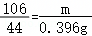 m=0.954g,碳酸钠质量分数=
m=0.954g,碳酸钠质量分数=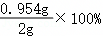 =47.7%;
故答案为:47.7%。
【实验探究3】(1)①固体样品加入形成溶液,操作为溶解,操作②实现固液分离,常用方法为过滤,溶液得到固体,采用蒸发结晶方法;溶解时玻璃棒搅拌可以加快溶解;
故答案为:溶解、过滤、蒸发结晶;玻璃棒。
(2)提出氢氧化钠,将碳酸钠全部去除,同时不引入新杂质,碳酸钠可与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以过滤去除,剩余只有氢氧化钠,书写化学方程式注意配平及沉淀符号,所以化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(3)最终得到的氢氧化钠有原先样品中的氢氧化钠,另外还有生成的氢氧化钠,因此得到的氢氧化钠比原样品质量大;
故答案为:大于。
【实验反思】(1)根据题目要求和实验设计过程,需要选择试剂种类,不引入其他影响现象判断的情况,同时提纯时需要考虑试剂用量,避免引入新的杂质,试剂产地无关影响,只要确保是所选试剂即可,在验证物质是否变质时需要设计合理的实验步骤,确保内部所需检验物质都可以被检测,同时不得造成环境影响,减少实验误差,确保实验结果的准确性;
故答案为:①②④⑤⑥。
(2)实验探究1是说明氢氧化钠变质含有碳酸钠,而实验探究3则是将碳酸钠去除,进行氢氧化钠的提出;
故答案为:实验探究1证明含有碳酸钠,实验探究3去除碳酸钠。
=47.7%;
故答案为:47.7%。
【实验探究3】(1)①固体样品加入形成溶液,操作为溶解,操作②实现固液分离,常用方法为过滤,溶液得到固体,采用蒸发结晶方法;溶解时玻璃棒搅拌可以加快溶解;
故答案为:溶解、过滤、蒸发结晶;玻璃棒。
(2)提出氢氧化钠,将碳酸钠全部去除,同时不引入新杂质,碳酸钠可与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以过滤去除,剩余只有氢氧化钠,书写化学方程式注意配平及沉淀符号,所以化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(3)最终得到的氢氧化钠有原先样品中的氢氧化钠,另外还有生成的氢氧化钠,因此得到的氢氧化钠比原样品质量大;
故答案为:大于。
【实验反思】(1)根据题目要求和实验设计过程,需要选择试剂种类,不引入其他影响现象判断的情况,同时提纯时需要考虑试剂用量,避免引入新的杂质,试剂产地无关影响,只要确保是所选试剂即可,在验证物质是否变质时需要设计合理的实验步骤,确保内部所需检验物质都可以被检测,同时不得造成环境影响,减少实验误差,确保实验结果的准确性;
故答案为:①②④⑤⑥。
(2)实验探究1是说明氢氧化钠变质含有碳酸钠,而实验探究3则是将碳酸钠去除,进行氢氧化钠的提出;
故答案为:实验探究1证明含有碳酸钠,实验探究3去除碳酸钠。
[点评]
本题考查了"实验探究物质的组成成分以及含量,固体物质的溶解,过滤所需的仪器,蒸发,碱的化学性质,盐的化学性质,书写化学方程式、文字表达式、电离方程式,",属于"压轴题",熟悉题型是解题的关键。