[考点]
合金与合金的性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,
[解析]
解:(1)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如制作保险丝选用武德合金是因为它的熔点低.
(2)①合金有金属光泽,故①说法错误;
②合金的硬度一般比其组分金属大,故②说法正确;
③合金能导电传热,故③说法错误;
④合金中含有金属元素或非金属等,故④说法错误;
⑤合金属于混合物,故⑤说法错误.
(3)铝、铁、铜是人类广泛使用的三种金属,为了探究Fe、Cu、Al的金属活动性顺序,小明选用了Al2(SO4)3溶液、CuSO4溶液和Fe.铁不能与Al2(SO4)3溶液反应,铁能与CuSO4溶液反应,说明了三种的金属的活动性强弱是:铝>铁>铜,实验的现象是:在铁的表面有红色物质生成,溶液由蓝色变为浅绿色,发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
(4)①根据Al、Fe与稀硫酸反应产生气泡的快慢,进行判断金属活动性:铝大于铁,而铜不与稀硫酸反应,说明铜的活动性最差,能得出Fe、Cu、Al的金属活动性顺序;
②铝能置换出硫酸亚铁中的铁,说明铁的活动性比铝弱,铜不能置换出硫酸亚铁中的铁,说明铁的活动性比铜强,能得出Fe、Cu、Al的金属活动性顺序;
③铝能置换出硫酸亚铁中的铁,硫酸铜溶液中的铜,说明金属活动性是铝大于铁、铜,但铁与铜的活动性无法比较,不能得出Fe、Cu、Al的金属活动性顺序.
故答案为:(1)低;(2)②;(3)在铁的表面有红色物质生成,溶液由蓝色变为浅绿色,Fe+CuSO4═FeSO4+Cu;(4)方案三.
[点评]
本题考查了"合金与合金的性质,金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式,",属于"典型题",熟悉题型是解题的关键。
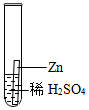
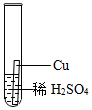
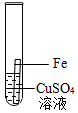
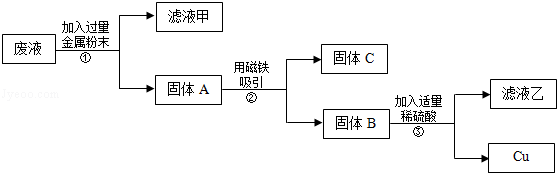
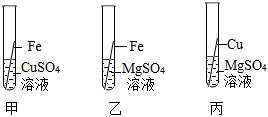

 实验中一个能发生反应的化学方程式 。
实验中一个能发生反应的化学方程式 。 ?
?