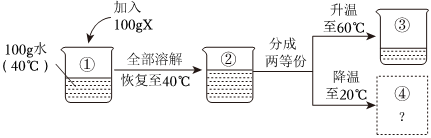
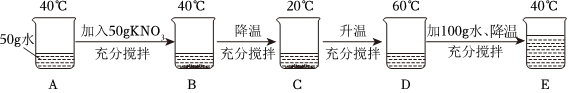
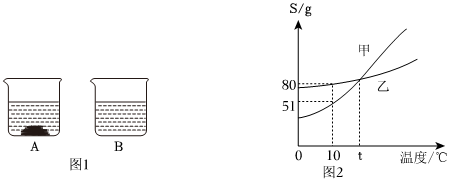
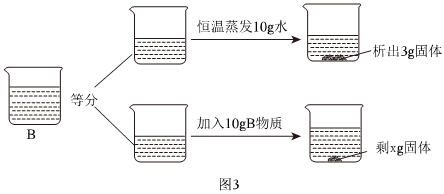
[考点]
饱和溶液和不饱和溶液,晶体和结晶的概念与现象,固体溶解度的概念,有关溶质质量分数的简单计算,
[答案]
(1)2:5;
(2)9;
(3)不饱和;203.9。
[解析]
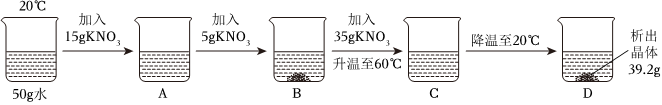
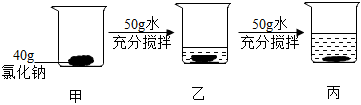
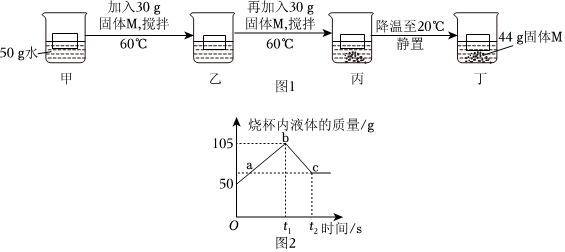
解:(1)40℃时,氯化钾的溶解度为40.0g,其含义是40℃时,100g水中最多溶解40.0g氯化钾,溶液达到饱和状态,则40℃时,将30gKCl固体加入到50g水中,充分搅拌后,最多能溶解20.0g,所得溶液中溶质与溶剂的质量之比为20.0g:50g=2:5。
(2)125g溶质质量分数为20%的KCl溶液中含氯化钾的质量为125g×20%=25g,含水的质量为125g﹣25g=100g。
20℃时,氯化钾的溶解度为34.0g,则变为该温度下的饱和溶液,至少应向溶液中再加入34.0g﹣25g=9g氯化钾。
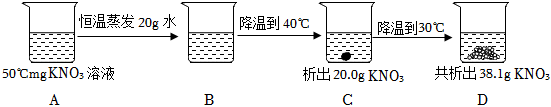
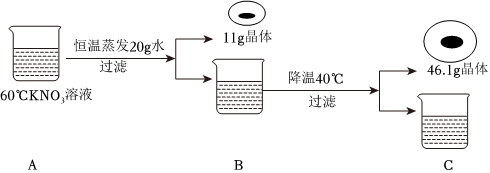
(3)50℃时,mgKNO3溶液恒温蒸发20g水,没有晶体析出,降温至40℃,析出20.0g晶体,此时所得溶液为40℃时硝酸钾的饱和溶液,再降温至30℃,共析出38.1g晶体,即降温至30℃,析出38.1g﹣20.0g=18.1g晶体。
40℃时硝酸钾的溶解度为63.9g,30℃时硝酸钾的溶解度为45.8g,则溶液中水的质量为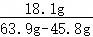 ×100g=100g。
m=100g+20g+45.8g+38.1g=203.9g。
50℃时,mgKNO3溶液恒温蒸发20g水,此时溶液的水质量为100g,50℃时硝酸钾的溶解度为85.5g,若是饱和溶液,此时饱和溶液的质量应为85.5g+100g=185.5g,而实际上溶液的质量为203.9g﹣20g=183.9g,则B溶液是不饱和溶液。
故答案为:
(1)2:5;
(2)9;
(3)不饱和;203.9。
×100g=100g。
m=100g+20g+45.8g+38.1g=203.9g。
50℃时,mgKNO3溶液恒温蒸发20g水,此时溶液的水质量为100g,50℃时硝酸钾的溶解度为85.5g,若是饱和溶液,此时饱和溶液的质量应为85.5g+100g=185.5g,而实际上溶液的质量为203.9g﹣20g=183.9g,则B溶液是不饱和溶液。
故答案为:
(1)2:5;
(2)9;
(3)不饱和;203.9。
[点评]
本题考查了"饱和溶液和不饱和溶液,晶体和结晶的概念与现象,固体溶解度的概念,有关溶质质量分数的简单计算,",属于"综合题",熟悉题型是解题的关键。
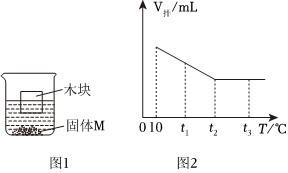
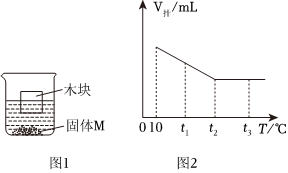
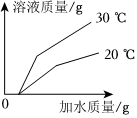
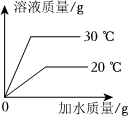
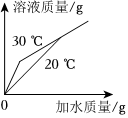
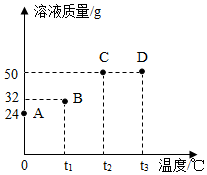 将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。
将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。