服务热线
搜题▪组卷
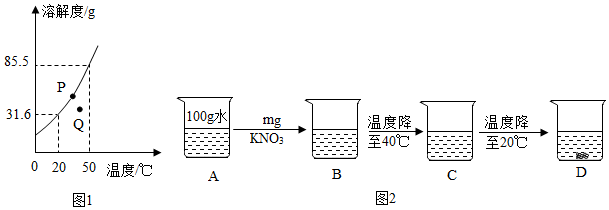
 列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。
列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | |
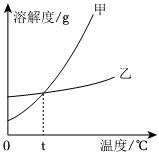
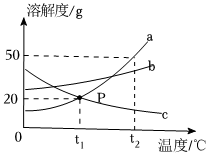
 如图是甲、乙两种固体物质的溶解度曲线。据图回答:?
如图是甲、乙两种固体物质的溶解度曲线。据图回答:?| 温度/℃ | 20 | 32.4 | 40 | 60 | 80 | 100 | |
| 溶解度/g | NaCl | 36.0 | 36.4 | 36.6 | 37.3 | 38.4 | 39.8 |
| Na2SO4 | 19.4 | 52.0 | 48.4 | 45.3 | 43.7 | 42.3 | |

| 温度/℃ | 10 | 20 | 40 | 60 |
| 溶解度/g | 21 | 32 | 64 | 110 |
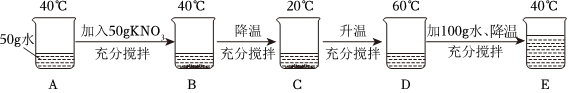

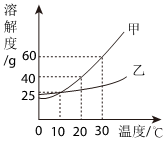
 如图是两种固体物质的溶解度随温度变化的曲线图,据图答:
如图是两种固体物质的溶解度随温度变化的曲线图,据图答:
| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | |

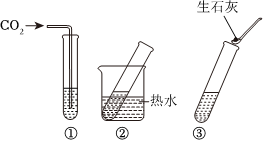
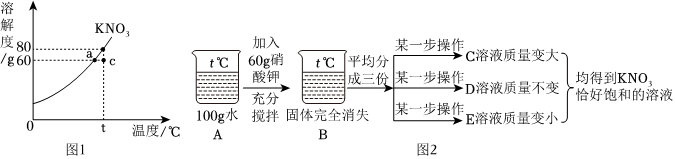
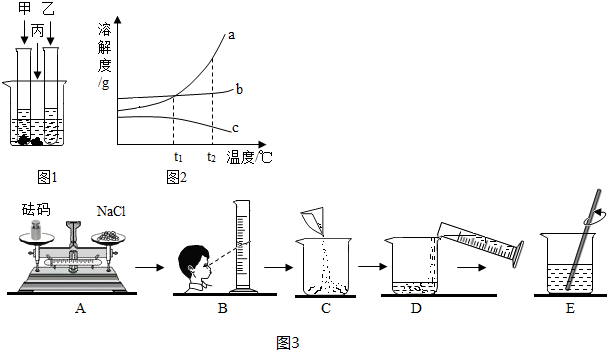
 如图所示是a、b、c、三种固体物质的溶解度曲线。
如图所示是a、b、c、三种固体物质的溶解度曲线。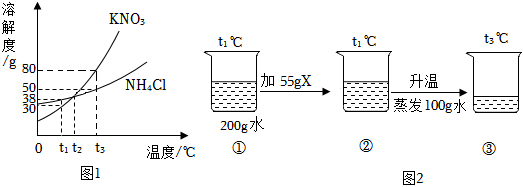

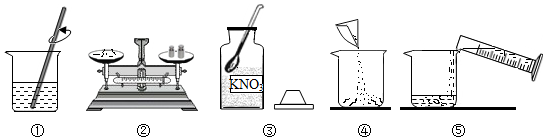
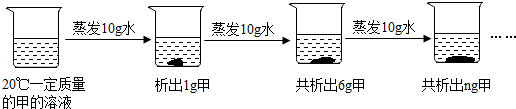
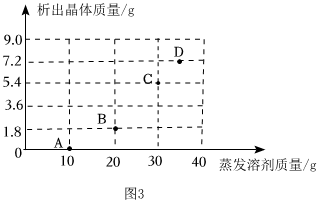
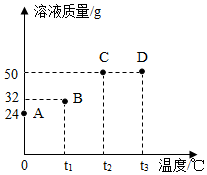 将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。
将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得溶液的质量分别如图中A、B、C、D点所示。回答下列问题:(1)0℃时,物质X的溶解度是 。
jsx@dyw.com
2023-03-14
初中化学 | | 填空题