[答案]
(1)2NaOH+H2SO4=Na2SO4+2H2O;
(2)黑色粉末逐渐溶解,溶液由无色变蓝色;
(3)溶液变红;
(4)Na2SO4、Na2CO3;
(5)2。
[解析]
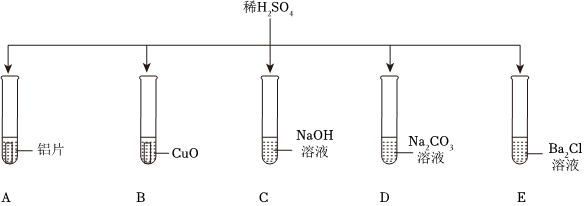
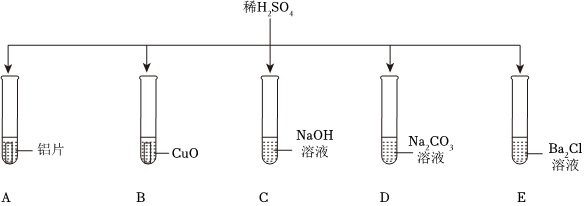
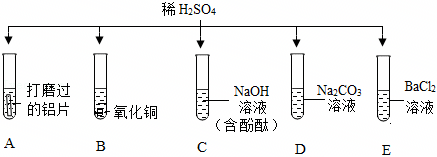
解:(1)试管C中氢氧化钠与硫酸反应生成硫酸钠和水,反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(2)氧化铜与硫酸反应生成硫酸铜和水,可观察到黑色粉末逐渐溶解,溶液由无色变蓝色;
(3)试管E中氯化钡与硫酸反应生成硫酸钡沉淀和盐酸,盐酸呈酸性,能使紫色石蕊溶液变红;
(4)将D、E反应后试管中物质全部倒入一个烧杯中,观察到有气泡产生,说明D中碳酸钠过量,则倒入前试管D溶液中的溶质为碳酸钠和生成的硫酸钠,化学式为 Na2SO4、Na2CO3;
(5)将A、B反应后的试管中物质全部倒入一个烧杯中,观察到烧杯中有气泡产生且有红色固体析出,说明试管A中铁粉过量,溶质为硫酸亚铁,试管B中氧化铜反应完全,溶质为硫酸铜和硫酸。
①由分析可知,说明试管A中的铁粉与硫酸反应生成硫酸亚铁和氢气,则倒入前试管A中的溶液为浅绿色,故①说法不正确;
②由分析可知,倒入前试管B中稀硫酸有剩余,故②说法正确;
③铁、氢、铜的活动性:Fe>H>Cu,铁先与硫酸铜反应生成硫酸亚铁和铜,硫酸铜反应后,再与硫酸反应生成硫酸亚铁和氢气,则滤渣中一定有铜,可能有铁,故③说法不正确;
④由③的分析可知,铁先与硫酸铜反应生成硫酸亚铁和铜,硫酸铜反应完全后,再与硫酸反应生成硫酸亚铁和氢气,则滤液中一定有FeSO4,一定没有CuSO4,可能含有硫酸,故④说法不正确;
故选②。
故答案为:
(1)2NaOH+H2SO4=Na2SO4+2H2O;
(2)黑色粉末逐渐溶解,溶液由无色变蓝色;
(3)溶液变红;
(4)Na2SO4、Na2CO3;
(5)2。
[点评]
本题考查了"酸的化学性质,",属于"常考题",熟悉题型是解题的关键。
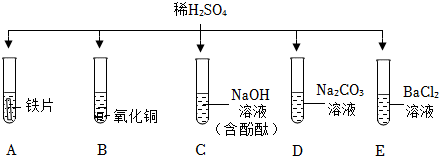
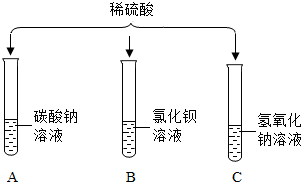
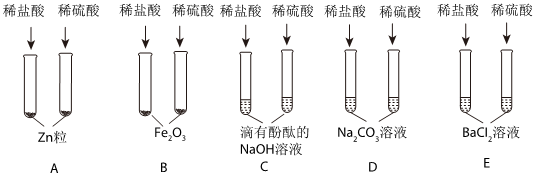
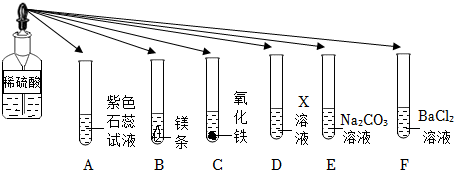
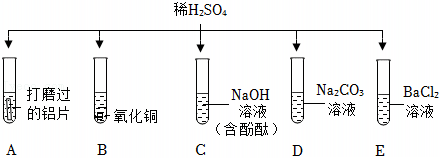
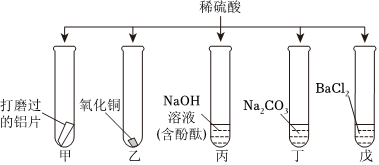
 如图所示,稀硫酸能与相连的物质发生化学反应。
如图所示,稀硫酸能与相连的物质发生化学反应。 为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题:
为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题: