服务热线
搜题▪组卷
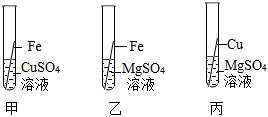
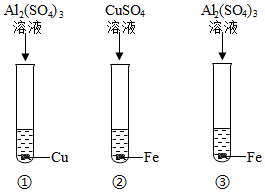 为验证铝、铁、铜的金属活动性顺序,某同学进行了以下实验。
为验证铝、铁、铜的金属活动性顺序,某同学进行了以下实验。| 你的一种猜想 | 验证方法 | 现象 | 结论 |
| 金属R的活动性比铁 | 将金属R投入到 溶液中 | 金属R表面有黑色物质析出 | 猜想 (选填“正确”或“错误”) |
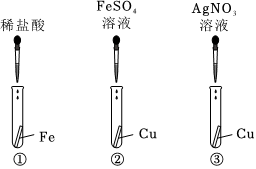 金属材料在人类发展的历史长河中起着非常重要的作用,如图是有关金属化学性质的实验,某同学为了验证铁、铜、银的金属活动性顺序及与氢的位置关系,做了①、②、③三个实验。
金属材料在人类发展的历史长河中起着非常重要的作用,如图是有关金属化学性质的实验,某同学为了验证铁、铜、银的金属活动性顺序及与氢的位置关系,做了①、②、③三个实验。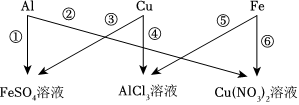 为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。
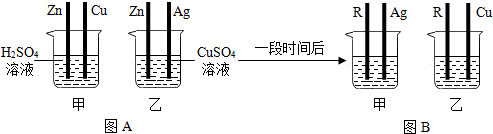
为验证铝、铜、铁的金属活动性顺序,同学们设计了如图所示的6个实验(“→”表示将金属丝加入盐溶液中)。
| 实验一 | 实验二 | 实验三 | |
|
实验操作 |
 |
 |
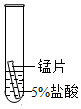 |
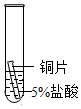
| 实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
| 实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为 | ||
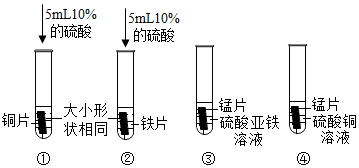
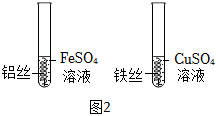
| 实验编号 | 1 | 2 | 3 |
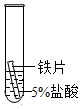
| 实验操作 |
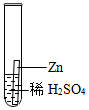
|
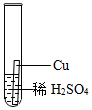
|
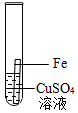
|
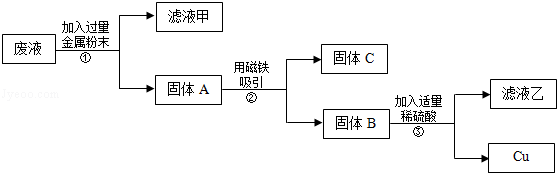

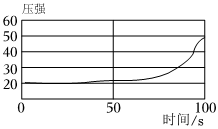
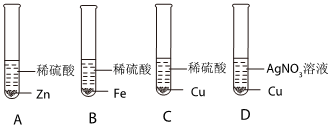
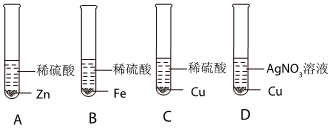
 实验中一个能发生反应的化学方程式 。
实验中一个能发生反应的化学方程式 。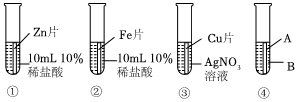

jsx@dyw.com
2025-04-26
初中化学 | | 填空题