[考点]
金属的物理性质及用途,金属与盐溶液反应的原理,酸的化学性质,
[答案]
(1)延展;
(2)Fe2O3+6HCl=2FeCl3+3H2O;
(3)BC。
[解析]
解:(1)冲压:操作中常对板材进行拉伸,这主要体现了金属材料的延展性;
(2)酸洗:用盐酸对铁制品进行除锈时观察到溶液变黄,该反应是氧化铁和盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
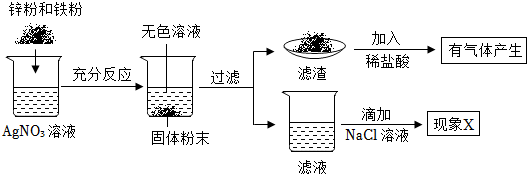
(3)实验:为了探究金属与盐溶液的反应规律,将ag锌粉和铁粉的混合物加入AgNO3溶液中,锌会先与硝酸银反应,铁再与硝酸银反应,充分反应后观察到烧杯底部有固体,上层清液为无色,所以铁一定没有与硝酸银硝酸银,滤渣中加盐酸有气泡产生,说明滤渣中一定含有铁,可能含有锌。
A、现象X一定没有白色沉淀生成,故错误;
B、滤渣中一定含有银、铁,故正确;
C、滤液中一定含有Zn2+,故正确;
D、每65份质量的锌和硝酸银反应生成硝酸锌和216份质量的银,所以滤渣的质量一定大于ag,故错误。
故选:BC。
故答案为:(1)延展;
(2)Fe2O3+6HCl=2FeCl3+3H2O;
(3)BC。
[点评]
本题考查了"金属的物理性质及用途,金属与盐溶液反应的原理,酸的化学性质,",属于"难典题",熟悉题型是解题的关键。
 金属与我们的生活息息相关。
金属与我们的生活息息相关。
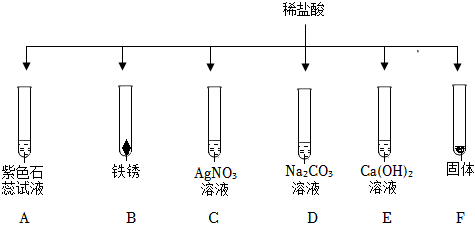
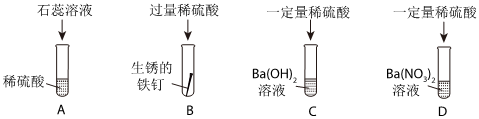
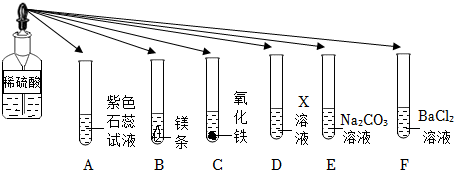
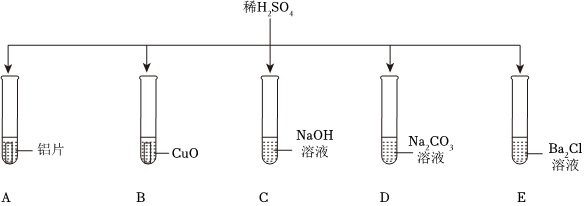
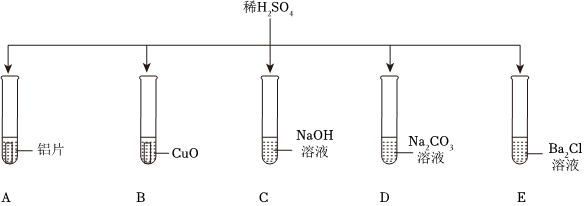
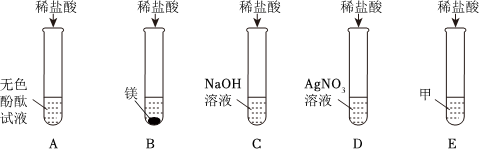
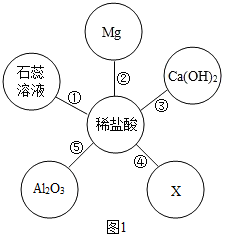
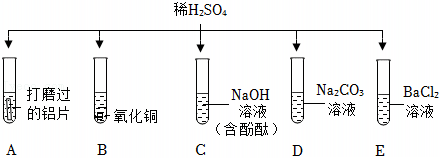
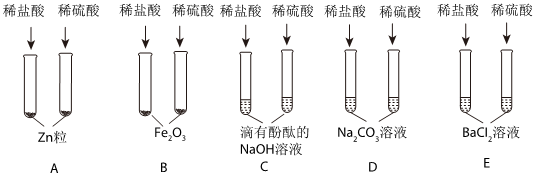
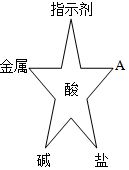 在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。
在化学复习课上,同学们对酸的化学性质进行了梳理和概括,并用如图表达了他们的研究成果。请你根据图回答下列问题。