服务热线
搜题▪组卷
| 操作 | 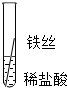 |
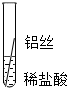 |
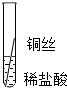 |
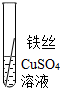
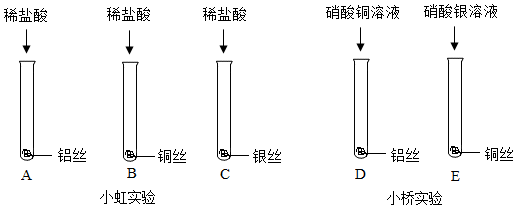
根据现象得出金属 活动性顺序 |
| 片刻后的现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后的现象 | 有少量气泡 | 有大量气泡 | 无气泡 |
| 操作 | 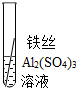 |
 |
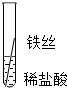
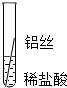
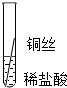
根据现象得出金属活动性顺序 |
| 现象 | Al>Fe>Cu |
| 操作 |
 |
 |
 |
根据现象得出金属 活动性顺序 |
| 片刻后的现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后的现象 | 有少量气泡 | 有大量气泡 | 无气泡 |
| 操作 |
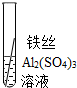 |
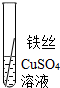 |
根据现象得出金属活动性顺序 |
| 现象 | Al>Fe>Cu |
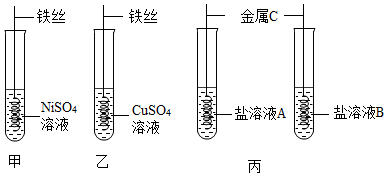
| 实验内容 | 实验步骤 | 实验现象 | 实验结论 |
| 方法一 | 分别截取三片大小相同的金属片与试管中,加入等质量等浓度的稀盐酸。 | 甲表面产生气泡,乙表面无气泡,丙表面开始无气泡,一段时间后快速产生气泡。 | 甲>丙>乙 |
| 方法二 | 将上述试验中未反应完的金属片取出,用蒸馏水冲洗干净后,将乙、丙金属片分别放入盛有少量硫酸亚铁溶液的A、B试管中,充分反应。 | A试管中无明显现象; B试管中溶液由浅绿色变为无色 |
金属活动性由强到弱的顺序是 |
| 方案 | 主要操作 | 主要现象 | 实验结论 |
| 甲 | 将打磨好的粗细相同的R丝、铁丝分别放在酒精灯火焰上灼烧 | R丝在空气中剧烈燃烧,铁丝在空气中 (选填“能”或“不能”)燃烧 | 金属活动性: |
| 将打磨好的铁丝插入放有硫酸铜溶液的试管中 | 金属活动性: Fe>Cu |
||
| 乙 | 打打磨好的R丝、铁丝、铜丝分别插入体积和浓度都相同的稀盐酸中 | R丝表面产生气泡速率比铁丝表面产生气泡速率 (选填“快”或“慢”)铜丝表面 气泡。 | 金属活动性: R>Fe>Cu |
| 实验一 | 实验二 | 实验三 | |
| 实验方案 |
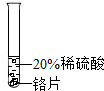
|
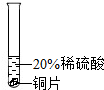
|

|
| 实验现象 | 铬片表面产生气泡缓慢,溶液变为蓝色 | 无明显现象 | 铝片表面产生气泡较快 |
| 结论 | 猜想 (填序号)成立 | ||
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验操作 | 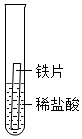 |
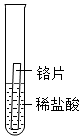 |
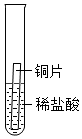 |
| 实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 |
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢,金属逐渐溶解 | 气体产生激烈,金属迅速溶解 | 无明显现象 |
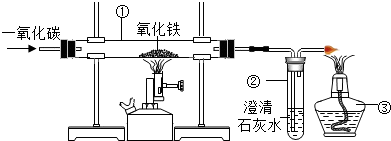
| 发生装置 | 收集装置 | 多功能瓶 |
 |  | 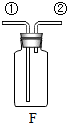 |
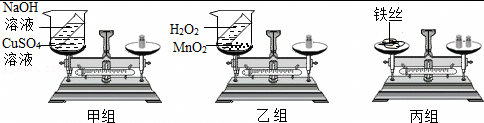
| 实验现象 | 化学方程式 | 结论 | |
| 甲组 | 产生蓝色沉淀,天平① (填“平衡”或“不平衡”) | ② | 该反应遵守质量守恒定律 |
| 乙组 | 烧杯中产生大量气泡,天平不平衡 | ③ | 该反应不遵守质量守恒定律 |
| 丙组 | ④ ,反应前后称量质量不相等 | 3Fe+2O2 |
该实验遵守质量守恒定律 |

dyhx2019
2021-03-02
初中化学 | 九年级上 | 实验题