[考点]
晶体和结晶的概念与现象,气体溶解度的影响因素,溶解度的相关计算,固体配制一定质量分数溶液,
[答案]
(1)减小;
(2)AE;
(3)①20;
②C=D>B>A;
③AC。
[解析]
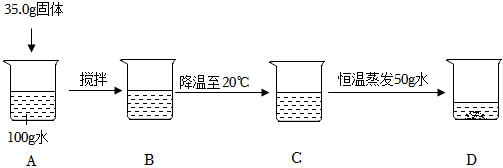
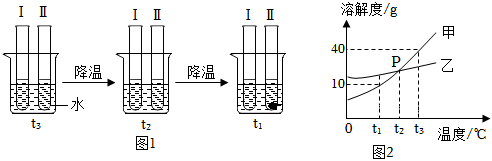
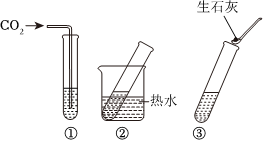
解:(1)打开雪碧瓶盖后有气泡冒出,原因是压强减小,气体溶解度减小,二氧化碳逸出;
(2)A、用固体配制一定溶质质量分数溶液的实验步骤为:计算、称量、量取、溶解、装瓶贴标签,所以正确的顺序为:③②④⑤①,符合题意;
B、量水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,会使所配溶液的溶质质量分数偏小,不符合题意;
C、该实验所需氯化钠的质量为:50g×6%=3g,所需水的质量为:50g﹣3g=47g,即47mL,量筒量程的选择,应遵循就近原则,故应选择50mL的量筒,不符合题意;
D、搅拌是为了加快溶解速率,不能增大氯化钠的溶解度,不符合题意;
E、将量好的水倒入烧杯时,有少量水洒出,会导致溶剂质量偏小,会使所配溶液的溶质质量分数偏大,符合题意。
故选:AE;
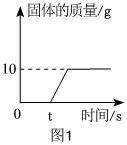
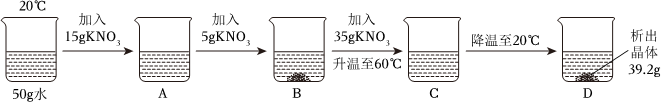
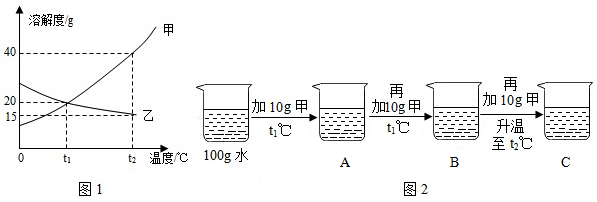
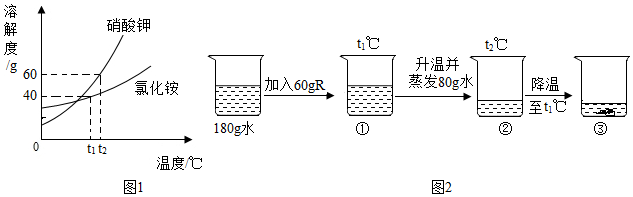
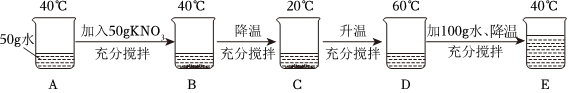
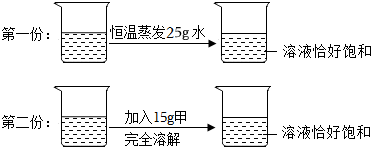
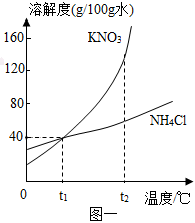
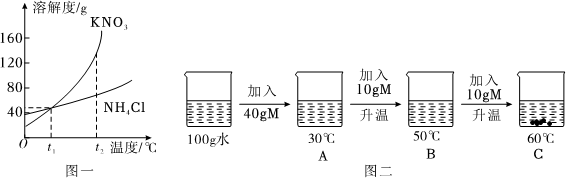
(3)①t1℃时,烧杯中溶液的质量为24g,即溶解的溶质质量为:24g﹣20g=4g,加入固体X的质量是30g,说明此时溶液是饱和溶液,说明该温度下,20g水中最多可溶解4gX,则该温度下,100g水中最多可溶解20gX,则t1℃时,该固体物质X的溶解度为20g;
②溶液A、B、C、D中溶剂质量相等,溶液质量:C=D>B>A,溶质质量:C=D>B>A,溶质质量分数:C=D>B>A;
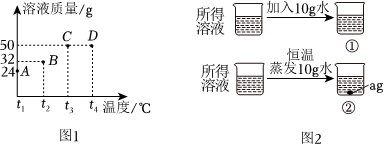
③A、t1℃时,该固体物质X的溶解度为20g,即该温度下,100g水中最多可溶解20gX,则10g水中最多可溶解2gX,即a的值为2,符合题意;
B、A溶液为饱和溶液,过滤后所得溶液也是饱和溶液,其中一份溶液加入10g水,则变为不饱和溶液,溶质质量分数变小,另一份溶液恒温蒸发10g水,有溶质析出,还是饱和溶液,温度不变,溶解度不变,饱和溶液的溶质质量分数不变,则与原溶液相比,烧杯①中溶液溶质质量分数减小,烧杯②中溶液溶质质量分数不变,不符合题意;
C、将烧杯①和烧杯②中物质混合后,相当于烧杯②蒸发的水又加回来,蒸发10g水析出的X又会溶解回去,符合题意。
故选:AC。
故答案为:(1)减小;
(2)AE;
(3)①20;
②C=D>B>A;
③AC。
[点评]
本题考查了"晶体和结晶的概念与现象,气体溶解度的影响因素,溶解度的相关计算,固体配制一定质量分数溶液,",属于"综合题",熟悉题型是解题的关键。

 列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。
列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。 列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。
列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。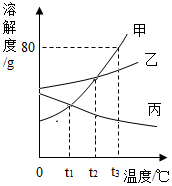 根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
根据如图甲、乙、丙三种固体物质的溶解度曲线,回答下列问题: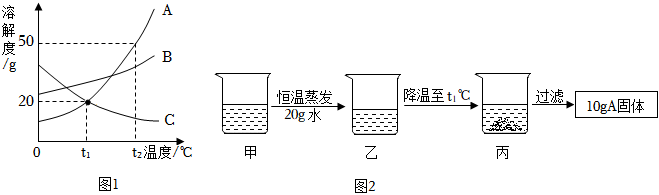


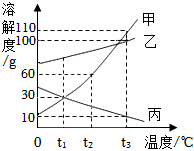
 下表是KNO3、NaCl在不同温度下的溶解度,请回答下列问题。
下表是KNO3、NaCl在不同温度下的溶解度,请回答下列问题。