服务热线
搜题▪组卷
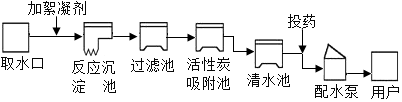
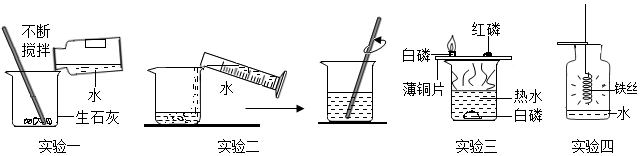
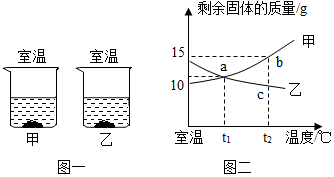
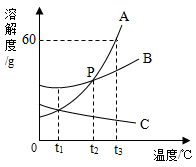
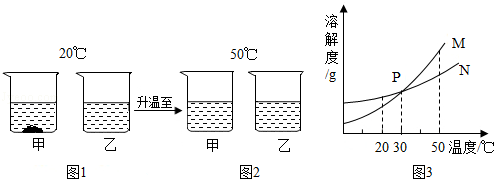
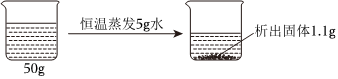
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | M | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 |
| N | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |

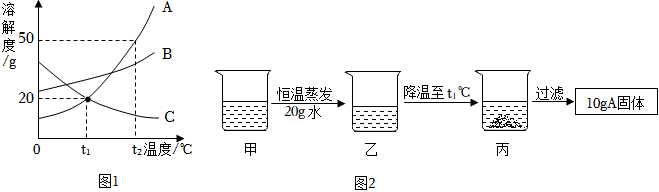
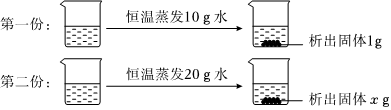
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| (g/100g水) | NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |


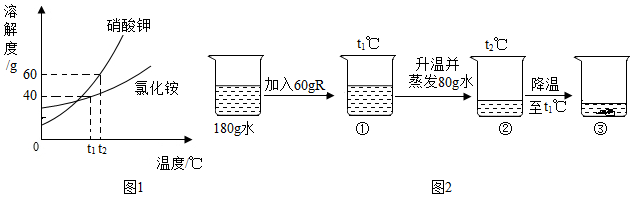
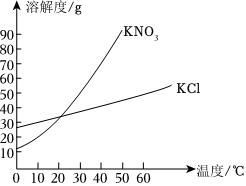
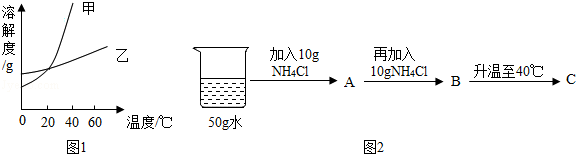
| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | |

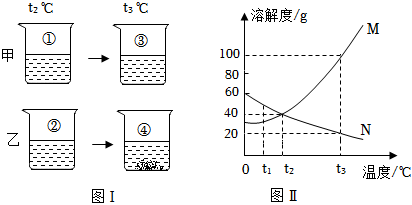

ty@dyw.com
2017-04-18
初中化学 | | 填空题