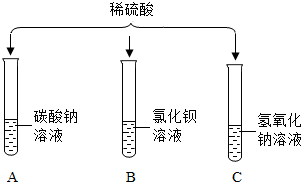
[考点]
物质除杂或净化的探究,溶液的酸碱度测定,过滤的原理、方法及其应用,酸的化学性质,
[解析]
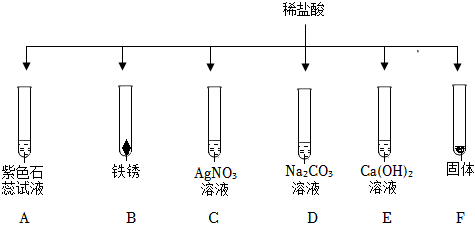
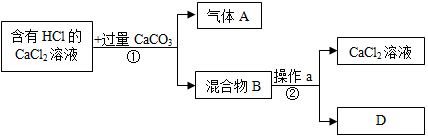
解:(1)步骤①中过量的碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)操作a是将过量的难溶于水的碳酸钙和氯化钙溶液进行分离,是过滤操作,需要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
(3)用pH试纸测定未知溶液的pH时,正确的操作方法为将pH试纸放在干燥玻璃片上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
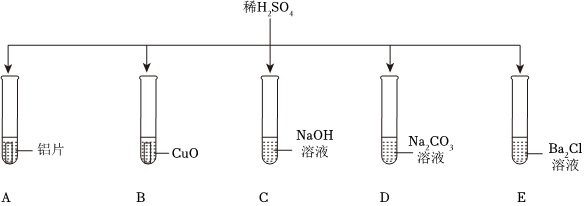
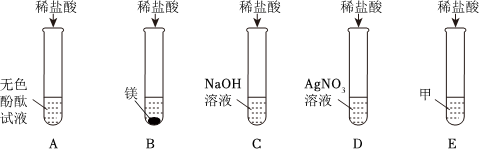
(4)A.硝酸银溶液与氯化钙、盐酸反应均生成氯化银白色沉淀,不能检验所得溶液中是否还有HCl.
B.碳酸钠溶液与稀盐酸反应生成氯化钠、水和二氧化碳,能检验所得溶液中是否还有HCl.
C.镁粉能与稀盐酸反应生成氯化镁和氢气,能检验所得溶液中是否还有HCl.
D.氧化铜能与稀盐酸反应生成氯化铜溶液和水,会观察到黑色粉末溶解,溶液变蓝色,能检验所得溶液中是否还有HCl.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)漏斗;(3)用玻璃棒蘸取少量待测液滴在干燥的pH试纸上;(4)BCD.
[点评]
本题考查了"物质除杂或净化的探究,溶液的酸碱度测定,过滤的原理、方法及其应用,酸的化学性质,",属于"综合题",熟悉题型是解题的关键。
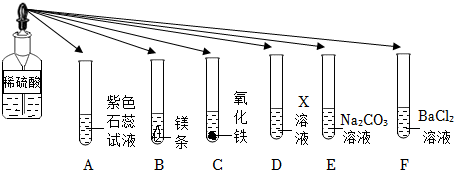
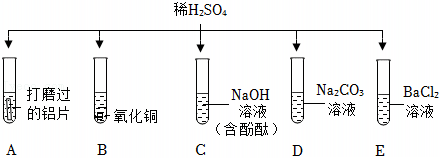
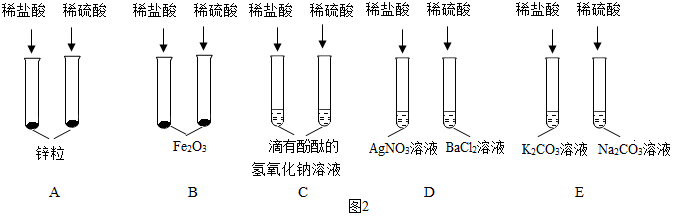
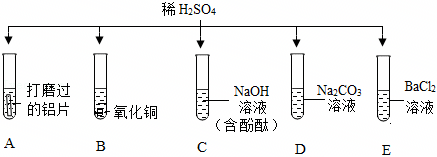
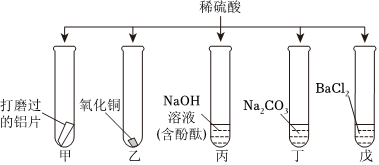
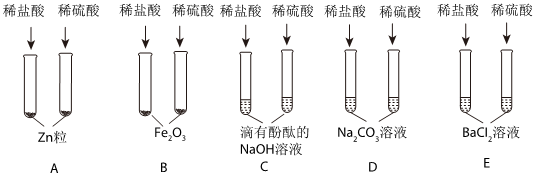
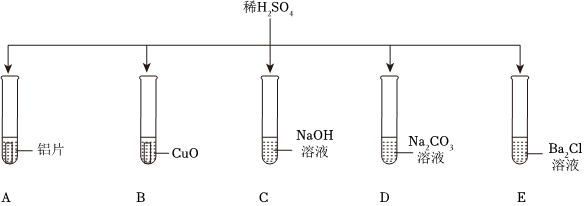
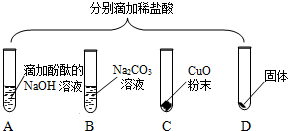 为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题:
为验证“酸的化学通性”,某班同学在实验室进行如图实验。请分析并回答相关问题: