服务热线
搜题▪组卷
| 温度/℃ 溶解度/g 物质 |
10 | 20 | 40 | 60 | 80 |
| 氯化钠 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 |
| 硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| 氢氧化钙 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |

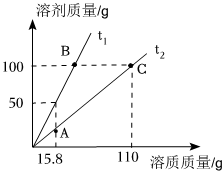 硝酸钾在不同温度下的溶解度如表所示,据此画出不同温度下硝酸钾在溶解时恰好达到饱和状态时溶质质量与溶剂质量的关系。
硝酸钾在不同温度下的溶解度如表所示,据此画出不同温度下硝酸钾在溶解时恰好达到饱和状态时溶质质量与溶剂质量的关系。| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31.6 | 63.9 | 110 | 169 | 240 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 溶解度/g | 13.3 | 20.9 | 31.6 | 45.8 | 64 | 85.5 |
| 温度/℃ | 0 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 7 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 | 45.1 | 44.7 |
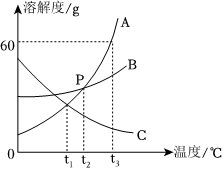
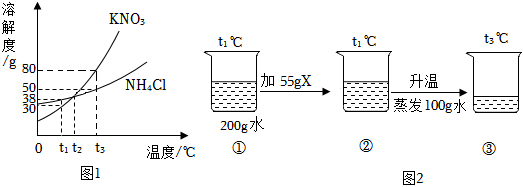
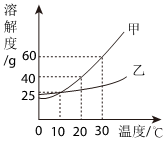 如图是甲、乙两种固体物质的溶解度曲线。据图回答:?
如图是甲、乙两种固体物质的溶解度曲线。据图回答:?
| 温度/℃ | 0 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 7 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 | 45.1 | 44.7 |
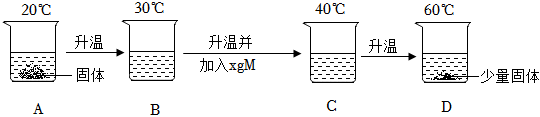

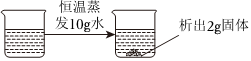
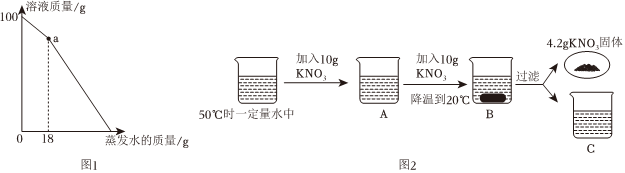
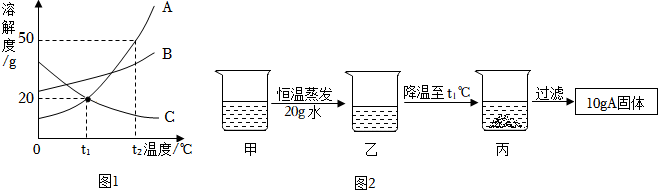
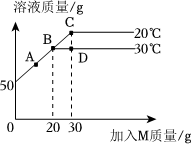 在不同温度下,向盛有50g水的烧杯中缓慢加入固体M,测得溶液质量与加入溶质M质量的变化关系如图,试回答下列问题:
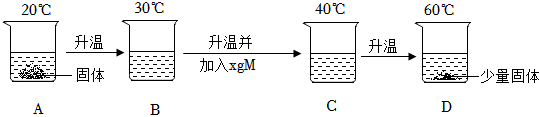
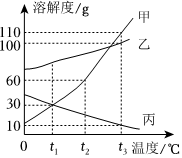
在不同温度下,向盛有50g水的烧杯中缓慢加入固体M,测得溶液质量与加入溶质M质量的变化关系如图,试回答下列问题: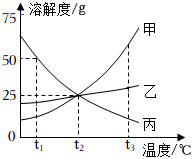 如图是甲、乙、丙三种物质的溶解度曲线。
如图是甲、乙、丙三种物质的溶解度曲线。
ybw@dyw.com
2023-04-15
初中化学 | | 填空题