服务热线
搜题▪组卷
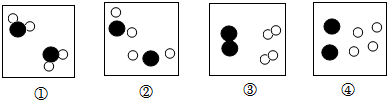
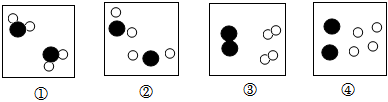
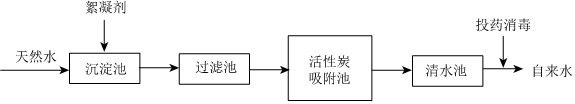
 央视栏目《典籍里的中国》展现了中国智慧,其中有许多古今对比。
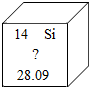
央视栏目《典籍里的中国》展现了中国智慧,其中有许多古今对比。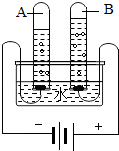
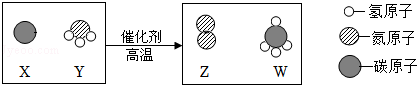 ?
?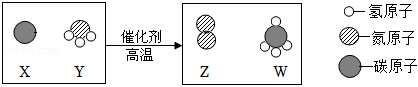 ?
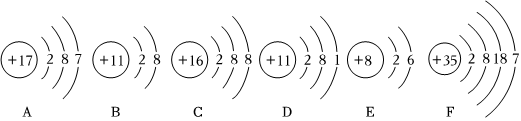
?
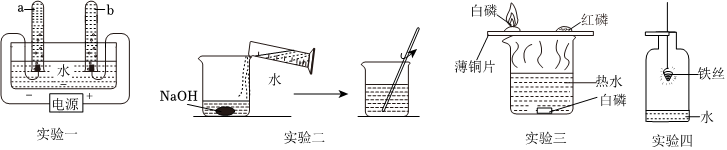
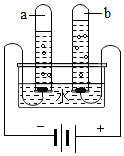 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。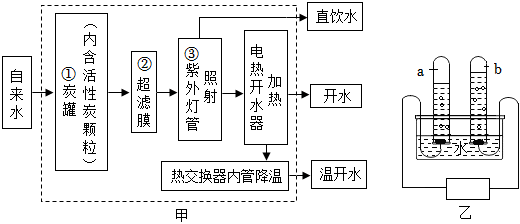

ybw@dyw.com
2025-04-16
初中化学 | | 填空题