[考点]
结晶的原理、方法及其应用,饱和溶液和不饱和溶液,晶体和结晶的概念与现象,
[答案]
(1)降温结晶;
(2)①不饱和;②3.57;
(3)18.3。
[解析]
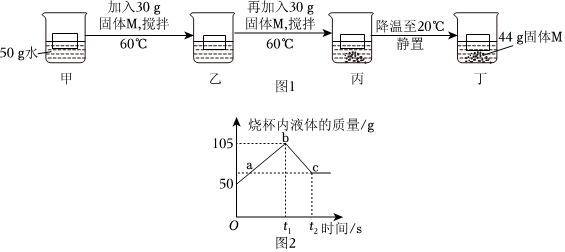
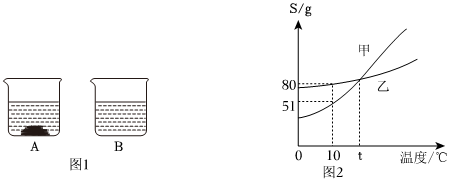
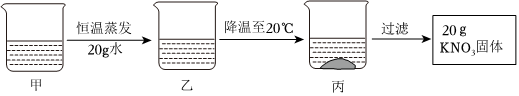
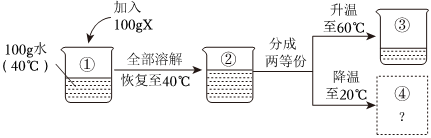
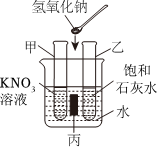
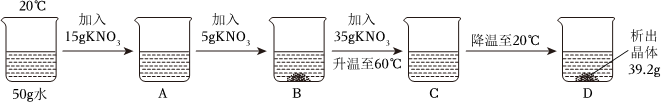
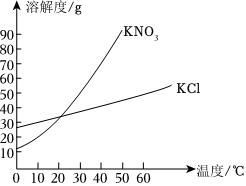
解:(1)KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度的影响变化较大,而氯化钠的溶解度受温度的影响变化较小,所以可采取加热水溶解配成饱和溶液、降温结晶使KNO3先结晶出来、再过滤的方法。
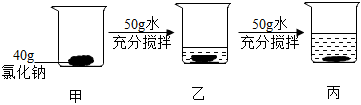
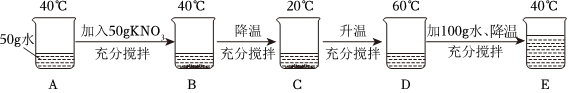
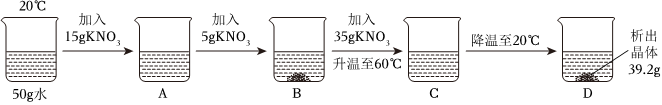
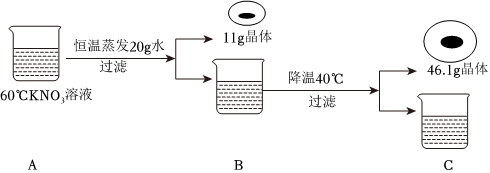
(2)①现有100g含NaCl和KNO3的样品,加入100g水中,加热至60℃,60℃时硝酸钾的溶解度为110.0g,氯化钠的溶解度为37.3g,则a溶液是KNO3在该温度下的不饱和溶液。
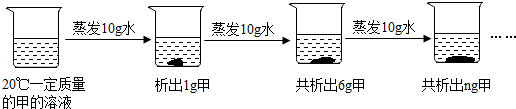
②20℃时硝酸钾的溶解度为31.6g,氯化钠的溶解度为36.0g,冷却至20℃,过滤,得到68.83g硝酸钾晶体,此时水中溶解的硝酸钾的质量为31.6g,样品中NaCl的质量为100g﹣31.6g﹣68.83g=3.57g。
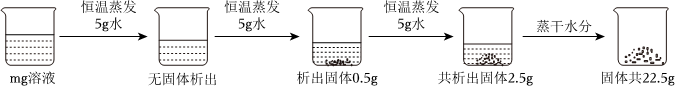
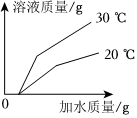
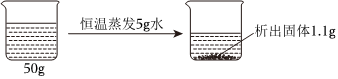
(3)40℃时,将150g一定溶质质量分数的NaCl溶液恒温蒸发溶剂,a点后,随着水的蒸发,溶液质量减少的变多,说明a点之前没有固体析出,a点溶液恰好饱和,a点时,蒸发水的质量为81.7g,40℃时,氯化钠的溶解度为36.6g,故a点溶液中溶质的质量为(150.0g﹣81.7g)×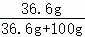 ×100%=18.3g。
故答案为:
(1)降温结晶;
(2)①不饱和;②3.57;
(3)18.3。
×100%=18.3g。
故答案为:
(1)降温结晶;
(2)①不饱和;②3.57;
(3)18.3。
[点评]
本题考查了"结晶的原理、方法及其应用,饱和溶液和不饱和溶液,晶体和结晶的概念与现象,",属于"难典题",熟悉题型是解题的关键。