[考点]
金属的物理性质及用途,金属与氧气的反应,金属活动性强弱的判断,
[答案]
(1)延展;
(2)CuO;
(3)①Fe+CuSO4=FeSO4+Cu;
②铁;
③Al2(SO4)3;<。
[解析]
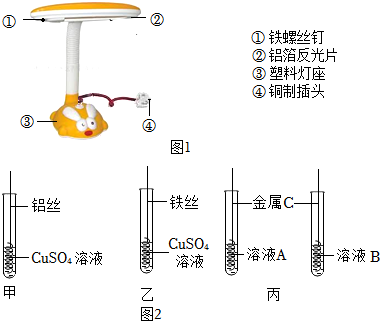
解:(1)把铝块制成铝箔,利用了铝的延展性。
(2)由图可知,废旧台灯是铜制插头,铜和氧气在加热的条件下生成氧化铜,所以在火焰上加热生成的黑色物质是:CuO。
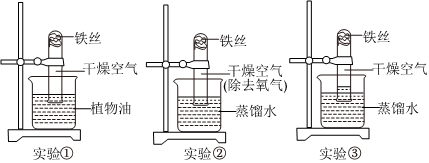
(3)①如图乙实验中发生的反应是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
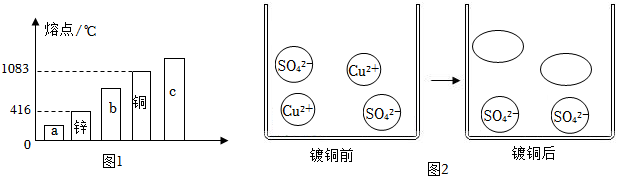
②仅利用丙实验,就能探究得出Fe、Al、Cu三种金属活动性强弱,则丙实验中的金属C是铁,溶液A、B分别是硫酸铝、硫酸铜溶液,将铁丝放入硫酸铝溶液中,铁不能置换出铝,说明铝的活动性强于铁,将铁丝放入硫酸铜溶液中,铁能置换出铜,说明铁的活动性强于铜,由此得出三种金属的活动性顺序为:铝>铁>铜。
③甲中铝和硫酸铜反应生成硫酸铝和铜,乙中铁和硫酸铜反应生成硫酸亚铁和铜,硫酸亚铁溶液为浅绿色,硫酸铜溶液为蓝色,将甲、乙两支试管中的所有物质全部转移到一只大烧杯中,铝和硫酸亚铁反应生成硫酸铝和铁,充分反应后发现溶液为无色,则溶液中一定含有的溶质是:Al2(SO4)3;由于铝的活动性最强,铝能置换出铁和铜,铝的化合价为+3,铁和铜的化合价为+2,铝的相对原子质量小于铁和铜,则该溶液的质量<混合前两支试管中溶液的质量之和。
故答案为:
(1)延展;
(2)CuO;
(3)①Fe+CuSO4=FeSO4+Cu;
②铁;
③Al2(SO4)3;<。
[点评]
本题考查了"金属的物理性质及用途,金属与氧气的反应,金属活动性强弱的判断,",属于"典型题",熟悉题型是解题的关键。