[考点]
常用气体的发生装置和收集装置与选取方法,气体的干燥(除水),
[答案]
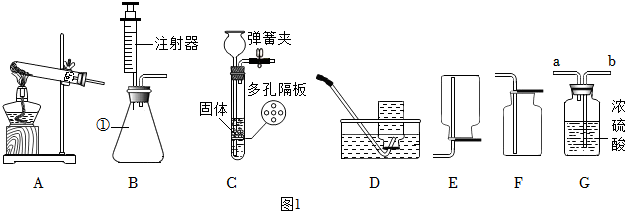
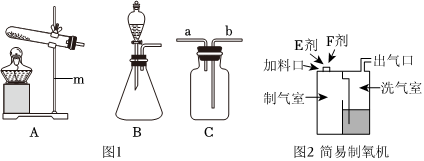
(1)锥形瓶;
(2)AD;
(3)可以控制反应速率;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)b;
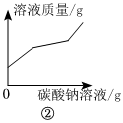
(5)②。
[解析]
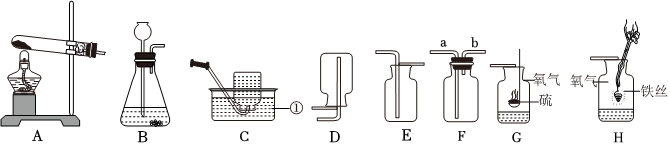
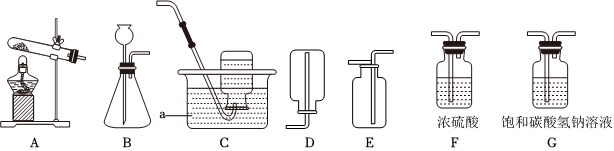
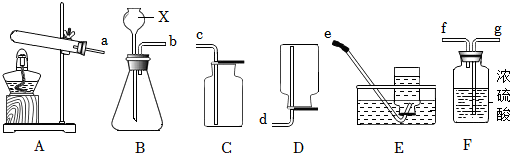
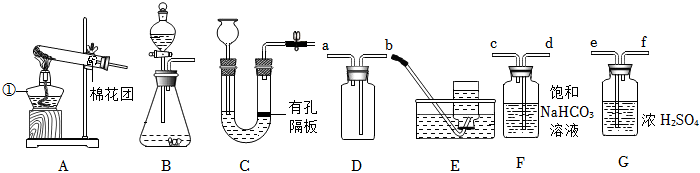
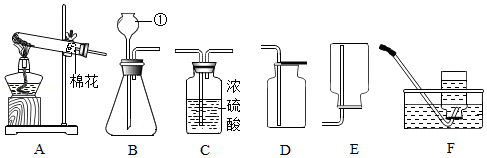
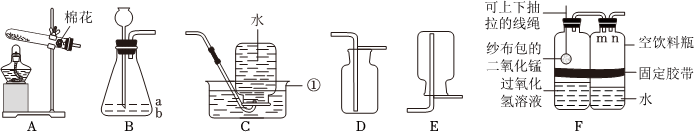
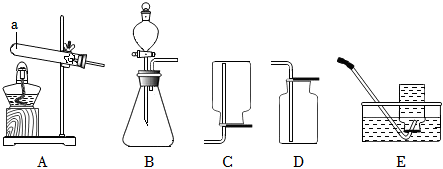
解:(1)由图可知,仪器①的名称为锥形瓶;
(2)实验室用高锰酸钾制取氧气,属于固体加热反应,发生装置可选A,氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,排水法收集的氧气比较纯净,故收集装置可选D;
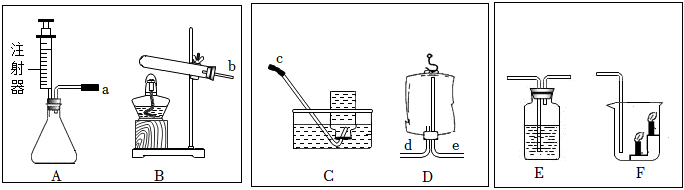
(3)装置B可通过注射器控制液体的滴加速率,从而控制反应速率;实验室通常用石灰石(或大理石)与稀盐酸反应制取二氧化碳,石灰石的主要成分碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
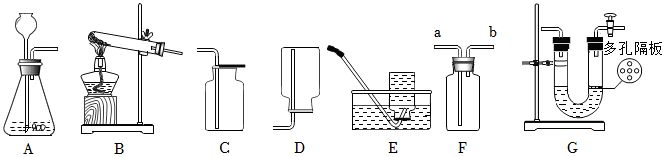
(4)若用装置G来干燥制取的二氧化碳,洗气应“长进短出”,故气体从b端通入;
(5)实验室通常用石灰石(或大理石)与稀盐酸反应制取二氧化碳,石灰石的主要成分碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,取废液的上层清液,逐滴加入碳酸钠溶液,观察到冒气泡和白色沉淀产生,说明废液中盐酸过量,废液中的溶质为氯化钙和氯化氢。
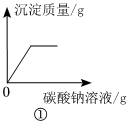
①逐滴加入碳酸钠溶液,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,故一开始无沉淀生成,后生成沉淀的质量逐渐增大,待完全反应后,不再变化,不符合题意;
②逐滴加入碳酸钠溶液,碳酸钠先与稀盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,106份质量的碳酸钠置换出44份质量的二氧化碳,溶液质量增加,待盐酸完全反应后,碳酸钠和氯化钙反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,106份质量的碳酸钠置换出100份质量的碳酸钙,溶液质量增加,但是增加幅度变小,继续滴加碳酸钠溶液,溶液质量继续增加,且无沉淀、气体生成,增加幅度变大,符合题意;
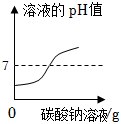
③一开始溶液中的溶质为氯化钙和氯化氢,溶液显酸性,pH<7,加入碳酸钠溶液,碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,pH逐渐增大,当恰好完全反应时,pH=7,后氯化钙和碳酸钠反应生成碳酸钙和氯化钠,该阶段pH始终等于7,继续滴加碳酸钠溶液,pH>7,不符合题意;
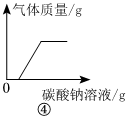
④逐滴加入碳酸钠溶液,碳酸钠先与盐酸反应生成氯化钠、二氧化碳和水,待盐酸完全反应后,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,故一开始气体的质量就逐渐增加,待完全反应后,不再变化,不符合题意。
故答案为:(1)锥形瓶;
(2)AD;
(3)可以控制反应速率;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)b;
(5)②。
[点评]
本题考查了"常用气体的发生装置和收集装置与选取方法,气体的干燥(除水),",属于"易错题",熟悉题型是解题的关键。