[考点]
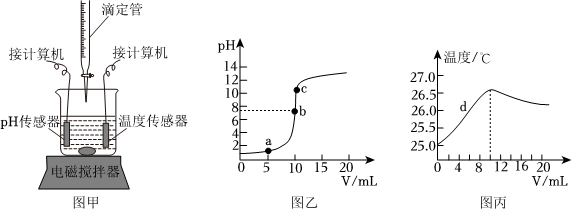
探究氢氧化钠溶液和稀盐酸发生中和反应时的温度变化、pH变化,
[答案]
(1)ABD;
(2)放出;AB;
(3)氢氧化钠溶液;de;
(4)无明显现象;
(5)CaCl2+Na2CO3=CaCO3↓+2NaCl。
[解析]
解:(1)A、酚酞遇碱性物质变红,遇中性物质或酸性物质不变色。NaOH溶液呈碱性,能使酚酞溶液变红,稀盐酸呈酸性,氯化钠溶液呈中性,都不能使酚酞变红,向NaOH溶液中滴加酚酞溶液,然后再滴加足量稀盐酸,若发现溶液由红色变为无色,说明NaOH已发生反应转化为其它物质,证明氢氧化钠溶液能与盐酸反应,故A正确;
B、Fe与NaOH、氯化钠都不反应,Fe能与稀盐酸反应生成FeCl2、H2,有气泡产生。向NaOH溶液中滴加适量稀盐酸,然后加入少量Fe,若没有气泡产生,说明稀盐酸已发生反应转化为其它物质,证明氢氧化钠溶液能与盐酸反应,故B正确;
C、氢氧化钠在溶液电离出Na+、OH﹣,HCl在溶液中电离出H+、Cl﹣。氢氧化钠与盐酸反应生成氯化钠、水,反应实质是H+、OH﹣结合生成H2O,稀盐酸中的Cl﹣不参与反应,不管氢氧化钠与盐酸是否发生反应,加入AgNO3,Cl﹣一定会与AgNO3反应生成AgCl白色沉淀,利用AgNO3溶液无法证明氢氧化钠溶液能与盐酸反应,故C错误;
D、Na2CO3与NaOH、氯化钠都不反应,Na2CO3能与稀盐酸反应生成NaCl、CO2、H2O,有气泡产生。向NaOH溶液中滴加适量稀盐酸,然后加入少量Na2CO3溶液,若没有气泡产生,说明稀盐酸已发生反应转化为其它物质,证明氢氧化钠溶液能与盐酸反应,故D正确;
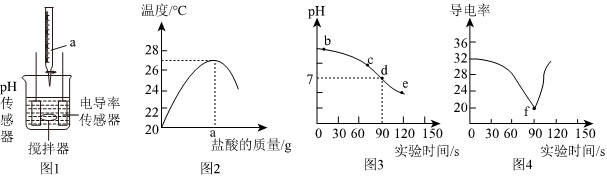
(2)A、稀盐酸呈酸性,pH小于7;氢氧化钠溶液呈碱性,pH大于7。根据图2,滴加a溶液后,烧杯中溶液的pH不断减小,说明滴加的溶液为稀盐酸,故正确;
B、氢氧化钠溶液呈碱性,pH大于7,图2中b→e过程中溶液pH不断减小且最终小于7,说明氢氧化钠不断减少,能证明稀盐酸和氢氧化钠溶液发生了反应,故正确;
C、图2中d点pH=7,说明稀盐酸与氢氧化钠溶液刚好完全反应,d→e过程中,加入稀盐酸,没有发生反应,NaCl的质量保持不变,故错误;
D、盐酸与氢氧化钠溶液反应生成氯化钠、水,则溶液中溶质由NaOH逐渐变为NaCl,NaOH在溶液中电离出Na+、OH﹣,NaCl在溶液中电离出Na+、Cl﹣,溶液中离子的数量没有改变,图3中90S之前电导率下降是因为OH﹣的导电能力比Cl﹣强,故错误。
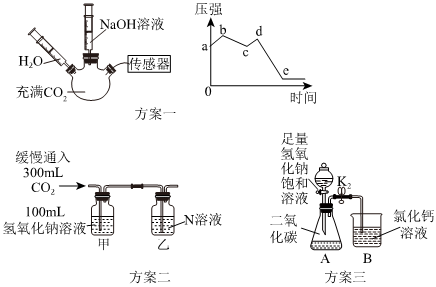
(3)氢氧化钠溶液中含有氢氧化钠、水,若要证明氢氧化钠与二氧化碳能发生化学反应,则实验变量是氢氧化钠,需先注入水,再注入氢氧化钠溶液并观察实验现象。若先注入氢氧化钠溶液,则无法控制变量。
根据图2,bc段瓶内压强小幅下降,de段压强明显下降,先注入的液体是水,后注入的液体是氢氧化钠溶液,对比bc、de段,可证明NaOH能与二氧化碳发生反应,消耗更多的二氧化碳。
(4)通常状况下1体积水中溶解1体积二氧化碳,集气瓶容积为250mL,甲集气瓶中氢氧化钠溶液体积为100mL,若氢氧化钠不能与二氧化碳反应,则通入的300mLCO2过量,最终有CO2进入乙集气瓶,若氢氧化钠能与CO2反应,则CO2不能进入乙集气瓶。因此乙集气瓶中溶液的作用是检验CO2,而CO2能使澄清石灰水变浑浊。若要证明集气瓶中二氧化碳能与氢氧化钠发生反应,则二氧化碳气体因被氢氧化钠吸收而不能进入乙装置,则乙装置中无明显现象。
(5)二氧化碳和氢氧化钠反应生成碳酸钠和水,而在打开K2后,氯化钙被吸入碳酸钠溶液中,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,其化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl。
故答案为:(1)ABD;
(2)放出;AB;
(3)氢氧化钠溶液;de;
(4)无明显现象;
(5)CaCl2+Na2CO3=CaCO3↓+2NaCl。
[点评]
本题考查了"探究氢氧化钠溶液和稀盐酸发生中和反应时的温度变化、pH变化,",属于"常考题",熟悉题型是解题的关键。

 ”表示的微粒是 (填微粒符号)。
”表示的微粒是 (填微粒符号)。
