服务热线
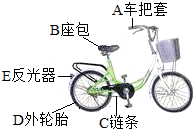 如图是同学们经常使用交通工具--自行车,请完成下列各题:
如图是同学们经常使用交通工具--自行车,请完成下列各题:
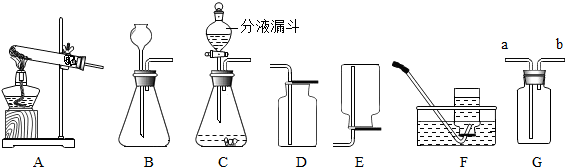
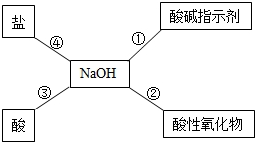 归纳总结是学习化学的重要方法,小明同学用如图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)
归纳总结是学习化学的重要方法,小明同学用如图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)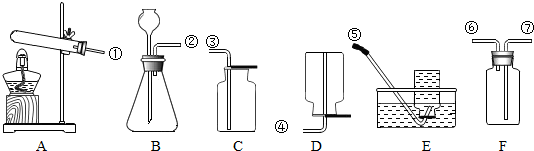
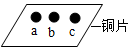 小明同学为了探究铜、铁、银三种金属的活动性强弱,做了如下实验。他找来一块铜片,用砂纸打磨干净,然后分别在a、b、c三处滴上不同的溶液:①在a处滴上稀HCl②在b处滴上FeSO4溶液③在c处滴上AgNO3溶液
小明同学为了探究铜、铁、银三种金属的活动性强弱,做了如下实验。他找来一块铜片,用砂纸打磨干净,然后分别在a、b、c三处滴上不同的溶液:①在a处滴上稀HCl②在b处滴上FeSO4溶液③在c处滴上AgNO3溶液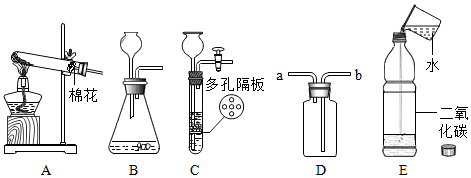
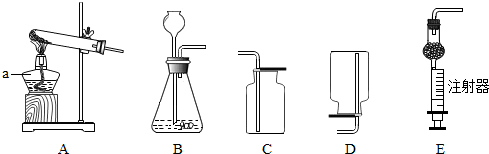
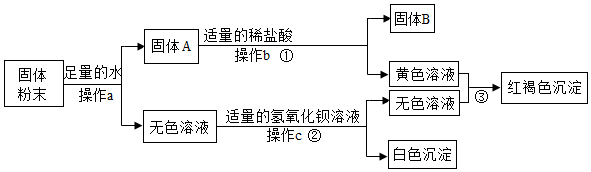
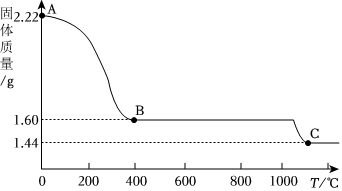
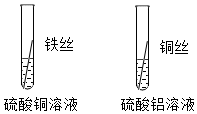 铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀盐酸、硫酸铜溶液、硫酸铝溶液,做了以下实验:
铁、铜、铝是生活中最常用的三种金属,小圆同学选取实验室提供的铁、铜、铝、稀盐酸、硫酸铜溶液、硫酸铝溶液,做了以下实验: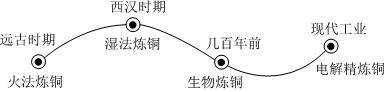

dyczhxyn
2023-06-15
初中化学 | | 解答题