服务热线
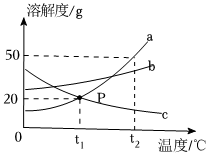 如图所示是a、b、c、三种固体物质的溶解度曲线。
如图所示是a、b、c、三种固体物质的溶解度曲线。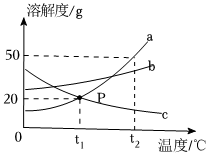 如图所示是a、b、c、三种固体物质的溶解度曲线。
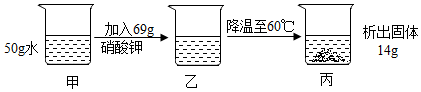
如图所示是a、b、c、三种固体物质的溶解度曲线。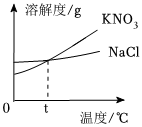 下表是KNO3、NaCl在不同温度下的溶解度,请回答下列问题。
下表是KNO3、NaCl在不同温度下的溶解度,请回答下列问题。| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37. | 37.3 | |
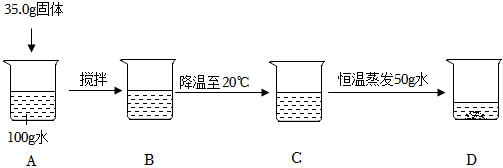
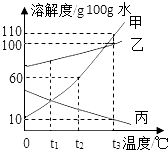 如图为甲、乙、丙三种固体物质溶解度曲线,据图回答:
如图为甲、乙、丙三种固体物质溶解度曲线,据图回答: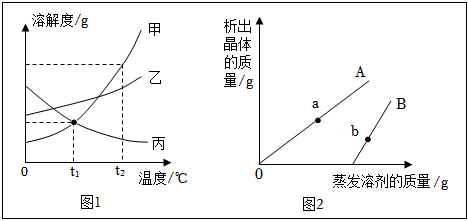
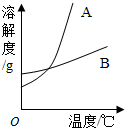
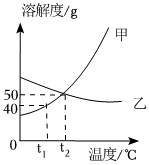 如图是两种固体物质的溶解度随温度变化的曲线图,据图答:
如图是两种固体物质的溶解度随温度变化的曲线图,据图答: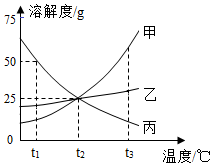 如图是甲、乙、丙三种物质的溶解度曲线。
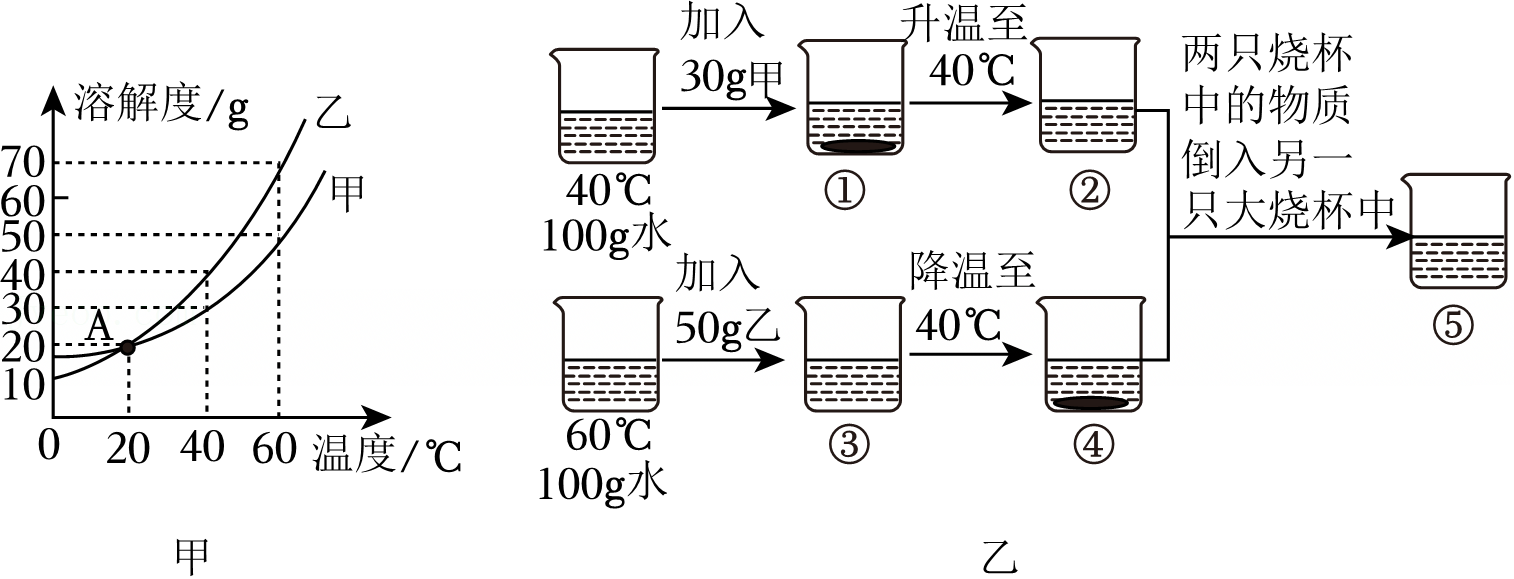
如图是甲、乙、丙三种物质的溶解度曲线。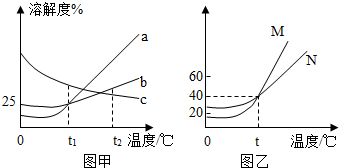
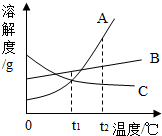
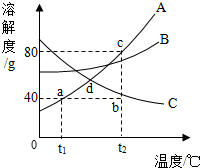 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: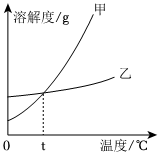 列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。
列表法和作图法是常用的数据处理方法。请根据下列图表进行分析。| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | |
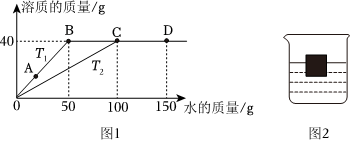
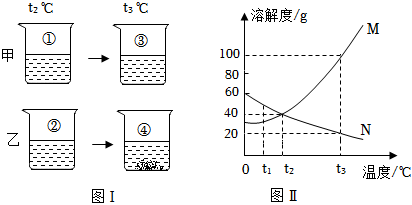
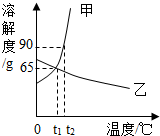 如图是甲、乙两种物质的溶解度曲线,请结合图示回答问题:
如图是甲、乙两种物质的溶解度曲线,请结合图示回答问题:| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | x | 138 |
| NaCl | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | |

dyczhxyn
2025-03-07
初中化学 | | 填空题