[考点]
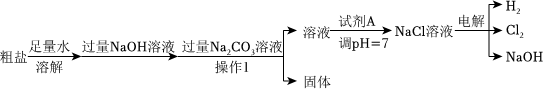
中和反应相关实验与计算,氯化钠与粗盐提纯,
[答案]
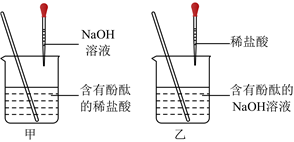
(1)溶液由红色变为无色;
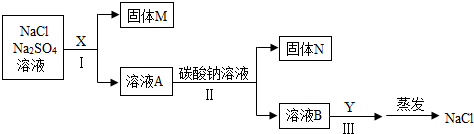
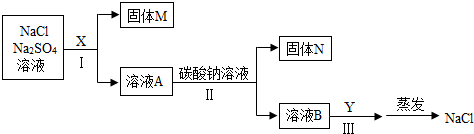
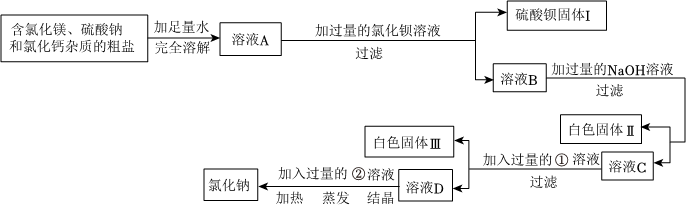
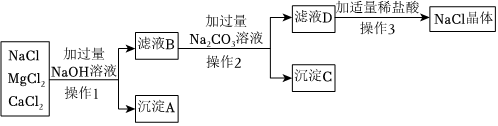
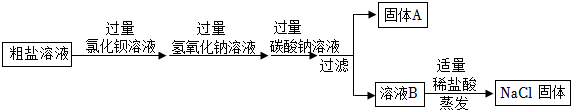
(2)①Na2SO4+BaCl2=BaSO4↓+2NaCl(或BaCl2+Na2CO3═BaCO3↓+2NaCl或Na2SO4+Ba(OH)2=BaSO4↓+2NaOH或Ba(OH)2+Na2CO3=2NaOH+BaCO3↓);除尽硫酸钠杂质;
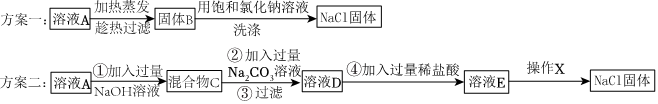
②甲实验直接生成氯化钠,不会造成试剂浪费,乙实验生成氢氧化钠,还需要加稀盐酸将其转化为氯化钠。
[解析]
解:(1)酚酞在碱性溶液中显红色,在中性和酸性溶液中无色。NaOH溶液呈碱性,滴有酚酞的NaOH溶液显红色。当向其中加入稀硫酸时,NaOH与稀硫酸发生中和反应,随着反应的进行,NaOH 逐渐被消耗,溶液碱性逐渐减弱,当NaOH完全反应后,溶液呈中性,此时溶液由红色变为无色。故答案为:溶液由红色变为无色;
(2)①甲同学选用BaCl2溶液,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式Na2SO4+BaCl2=BaSO4↓+2NaCl;碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;
乙同学选用Ba(OH)2溶液,氢氧化钡与硫酸钠反应生成硫酸钡沉淀和氢氧化钠,化学方程式Na2SO4+Ba(OH)2=BaSO4↓+2NaOH;氢氧化钡与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式为Ba(OH)2+Na2CO3=2NaOH+BaCO3↓;
所用试剂X要过量,是为了将溶液中的硫酸钠杂质完全反应掉,即除尽硫酸钠杂质。
故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl(或BaCl2+Na2CO3═BaCO3↓+2NaCl或Na2SO4+Ba(OH)2=BaSO4↓+2NaOH或Ba(OH)2+Na2CO3=2NaOH+BaCO3↓);除尽硫酸钠杂质;
②甲实验中BaCl2与Na2SO4反应直接生成了氯化钠,没有引入新的需要后续处理的物质,不会造成试剂浪费;而乙实验中Ba(OH)2与Na2SO4反应生成了氢氧化钠,为了得到纯净的氯化钠,还需要加稀盐酸将氢氧化钠转化为氯化钠,相比之下操作更复杂,所以甲的实验比乙的实验更合理。
故答案为:甲实验直接生成氯化钠,不会造成试剂浪费,乙实验生成氢氧化钠,还需要加稀盐酸将其转化为氯化钠。
[点评]
本题考查了"中和反应相关实验与计算,氯化钠与粗盐提纯,",属于"必考题",熟悉题型是解题的关键。