服务热线
搜题▪组卷
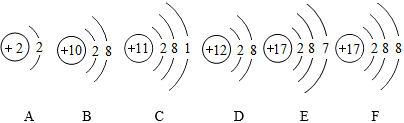
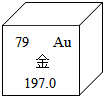
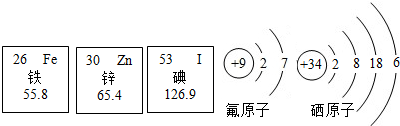
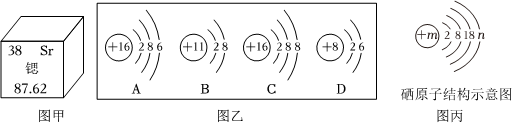
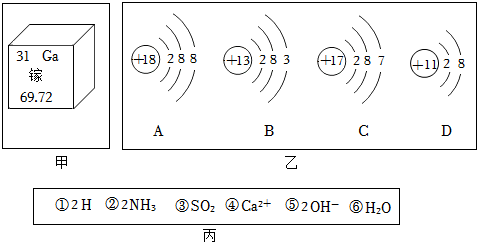 ?
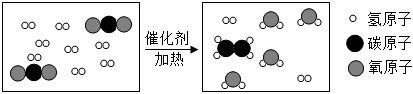
?

 2023年,我国汽车产销分别完成3016.1万辆和3009.4万辆,分别同比增长11.6%和12%,产销均首次超过3000万辆,连续15年保持全球第一,其中新能源汽车产销保持高速增长。
2023年,我国汽车产销分别完成3016.1万辆和3009.4万辆,分别同比增长11.6%和12%,产销均首次超过3000万辆,连续15年保持全球第一,其中新能源汽车产销保持高速增长。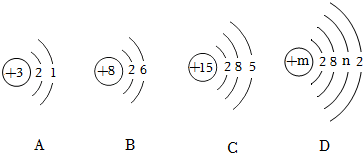
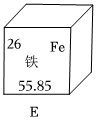
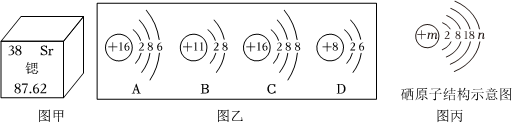
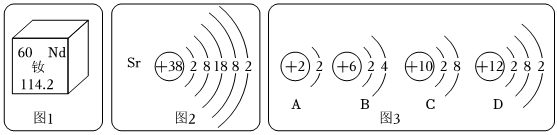
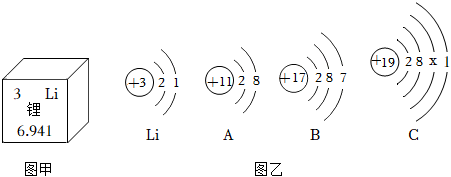
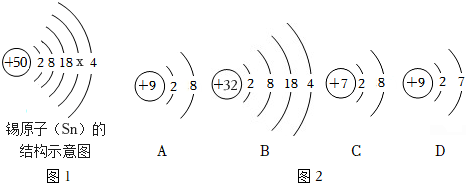
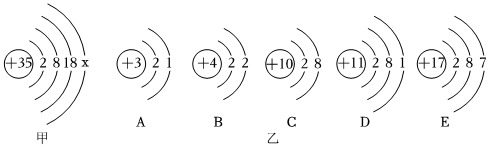
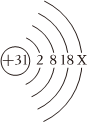 ,其中X= 。
,其中X= 。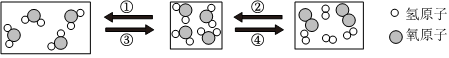 ?
?
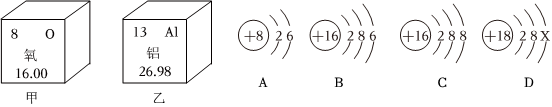

koe@dyw.com
2022-11-27
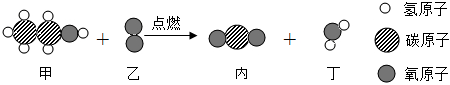
初中化学 | 九年级上 | 填空题