[解析]
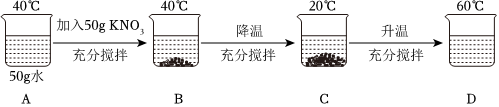
解:(1)由图看出,B为40℃时,硝酸钾的饱和溶液,40℃时,50g水中溶解了32g,故 KNO3的饱和溶液中溶质与溶剂的质量比为 32g:50g═16:25;故答案为:16:25;
(2)由表中的数据可知,50g水中达到饱和状态时溶解的最大质量为55g,而实验中加入的硝酸钾只有50g,因此得到的是硝酸钾的不饱和溶液;故答案为:不饱和;
(3)烧杯B中溶质的质量为32g,降温到20℃,烧杯C中溶质的质量为15,8g,烧杯D中溶质的质量为50g,故烧杯B、C、D中所得溶液的溶质质量分数的大小关系为D>B>C;故答案为:D>B>C;
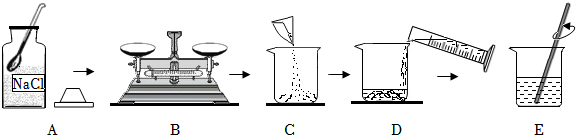
(4)①所需氯化钠的质量为:50g×15%=7.5g;水的质量为50g﹣7.5g=42.5g,合42.5mL;故应选50mL的量筒;故答案为:50;
②使用托盘天平称量药品时应遵循“左物右码”,称量过程中他发现指针偏右了,说明药品质量小于砝码质量,应增加药品,故选:A;
③A、用量筒量取水时俯视读数,读数偏大,实际水的体积取少了,导致氯化钠溶液溶质质量分数偏大;
B、用来配制溶液的烧杯刚用少量蒸馏水润洗过,实际水的体积取多了,导致氯化钠溶液溶质质量分数偏小;
C、所用砝码生锈,实际氯化钠取多了,导致氯化钠溶液溶质质量分数偏大;
D、配好的溶液装瓶时不小心洒出,由于溶液是均一的,氯化钠溶液溶质质量分数不变;
故选:AC。
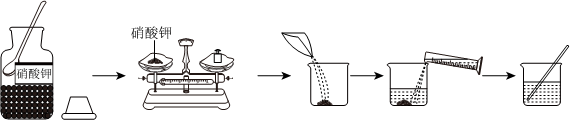
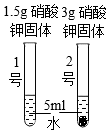 实验小组同学在一定温度下进行硝酸钾的固体的溶解实验。
实验小组同学在一定温度下进行硝酸钾的固体的溶解实验。