[考点]
根据酸的通性推断物质的性质,根据碱的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,
[解析]
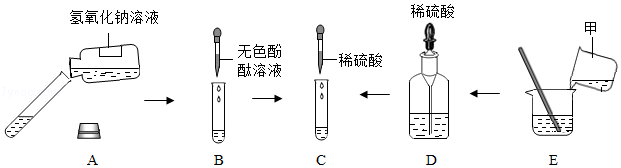
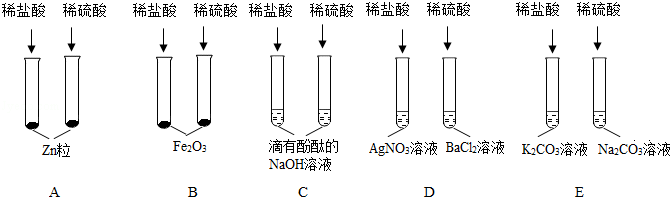
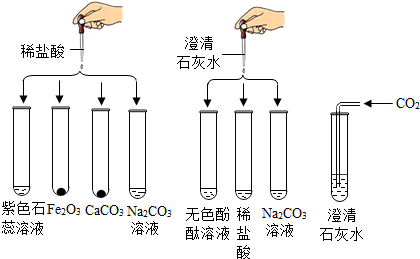
解:(1)酸能使紫色石蕊变红色,酸会与金属氧化物、活泼金属、盐、碱等物质反应,所以整个实验中没有体现酸和活泼金属反应的;
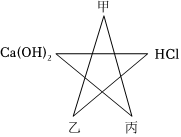
(2)向滤液中滴加稀盐酸,一段时间后有气泡出现,说明加入盐酸会先与,再与碳酸盐反应,氢氧化钙和碳酸钠反应会生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)氧化铁和盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,所以若该实验中酸过量,反应的现象为:铁锈溶解,溶液由无色变成黄色,一段时间后会出现气泡。
故答案为:(1)活泼金属;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)铁锈溶解,溶液由无色变成黄色,一段时间后会出现气泡。
[点评]
本题考查了"根据酸的通性推断物质的性质,根据碱的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,",属于"难典题",熟悉题型是解题的关键。
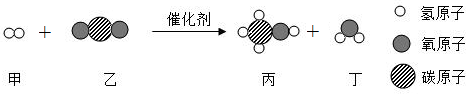
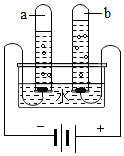 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。