[考点]
根据酸的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,
[答案]
(1)Mg+2HCl=MgCl2+H2↑;
(2)产生白色沉淀;
(3)Fe2O3;
(4)Na+、Mg2+。
[解析]
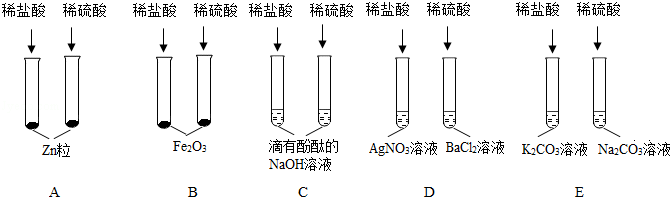
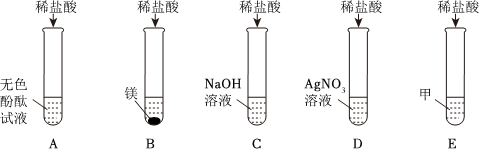
解:(1)试管B是镁和稀盐酸反应生成氯化镁和氢气,反应的方程式为:Mg+2HCl=MgCl2+H2↑;
(2)试管D是稀盐酸和硝酸银反应生成白色沉淀氯化银和稀硝酸,所以现象为产生白色沉淀;
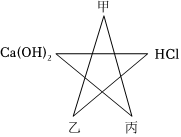
(3)甲属于氧化物,反应后E中溶液显黄色,酸能与金属氧化物反应,含铁离子的溶液是黄色的,所以试管E是氧化铁和稀盐酸反应生成氯化铁和水;
(4)反应后试管A中有盐酸和酚酞,试管B中有氯化镁,可能有盐酸,试管C中有氯化钠,可能有盐酸或氢氧化钠,试管D中有氯化银和硝酸,可能有盐酸或硝酸银,把A、B、C、D四支试管中的物质倒入一小烧杯中充分反应后过滤,得到无色滤液,说明滤液中没有氢氧化钠,氢氧化钠呈碱性,能使酚酞变红,向滤液中加入几滴氢氧化钠溶液,无明显现象。说明加入的氢氧化钠被反应了,能与氢氧化钠反应的有硝酸、盐酸、氯化镁,不可能只有氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀,故一定有酸,故滤液中一定有酸,则一定有氯化镁,因为如果试管C中有氢氧化钠剩余,氢氧化钠与酸先反应,然后与氯化镁反应,故滤液中一定有酸和氯化镁,滤液中没有硝酸银,硝酸银与氯化镁反应生成沉淀,试管C中的氯化钠混合后不能发生反应,故滤液中还有氯化钠,滤液中的金属阳离子一定有Na+、Mg2+。
故答案为:
(1)Mg+2HCl=MgCl2+H2↑;
(2)产生白色沉淀;
(3)Fe2O3;
(4)Na+、Mg2+。
[点评]
本题考查了"根据酸的通性推断物质的性质,书写化学方程式、文字表达式、电离方程式,",属于"易错题",熟悉题型是解题的关键。
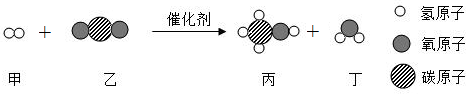
 在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。
在宏观、微观和符号之间建立联系是化学特有的思维方式。根据电解水的实验,回答下列问题。