[考点]
合金与合金的性质,原子结构示意图,元素周期表的特点及其应用,
[答案]
(1)12;
(2)C;
(3)硬度大(合理即可)。
[解析]
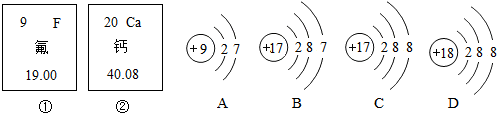
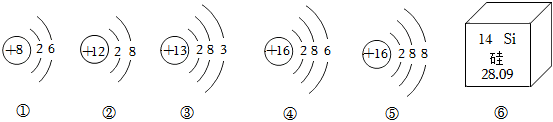
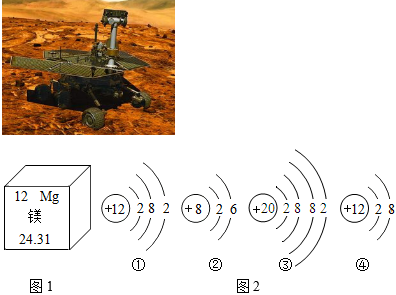
解:(1)根据元素周期表单元格内左上方数字表示原子序数,原子中:原子序数=核内质子数=核电荷数,则镁原子的核电荷数为12;
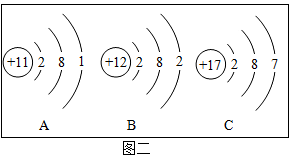
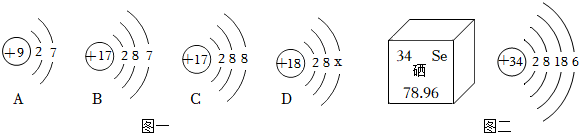
(2)A.质子数决定元素种类,核内质子数相同,元素种类相同,所以属于同种元素的是①④,故A正确;
B.原子中,最外层电子数相等,元素的化学性质相似,镁原子最外层电子数为2,③为钙原子结构示意图,钙原子最外层电子数为2,所以与镁原子化学性质相似的是③,故B正确;
C.原子的电子层数与周期数一致,②在第2周期,④的原子电子层数为3,在第3周期,故C错误;
D.③为钙原子结构示意图,钙原子最外层电子数为2,少于4个,在化学反应中容易失去2个电子,形成带两个单位正电荷的离子,符号为Ca2+,故D正确。
故选:C。
(3)合金与组成它的纯金属相比,合金的硬度和强度大、熔点低等。
故答案为:(1)12;
(2)C;
(3)硬度大(合理即可)。
[点评]
本题考查了"合金与合金的性质,原子结构示意图,元素周期表的特点及其应用,",属于"典型题",熟悉题型是解题的关键。

 ?
?