[考点]
金属活动性强弱的判断,元素的概念,周期表信息示意图及结构示意图的综合考查,
[答案]
(1)SO3;
(2)核内质子数(或核电荷数)不同;
(3)BE;Zn+2HCl=ZnCl2+H2↑。
[解析]
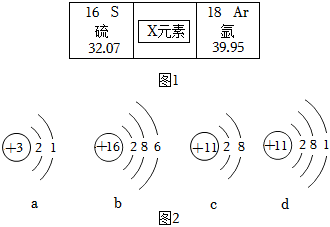
解:(1)反应前中有1个钛原子、4个氟原子、4个氢原子、2个硫原子、8个氧原子,反应后含有1个钛原子、4个氟原子、4个氢原子、2个氧原子,根据反应前后原子的种类和个数不变,故2X中含2个硫原子、6个氧原子,则X的化学式为SO3。
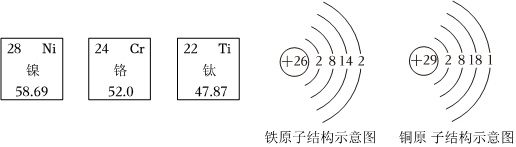
(2)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),镍、铬、钛、铜属于不同元素的本质原因是质子数(核电荷数)不同。
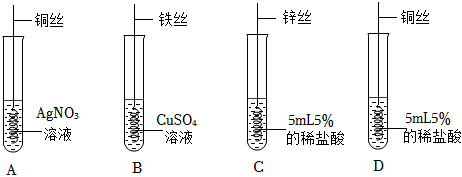
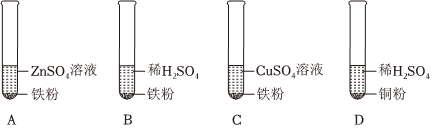
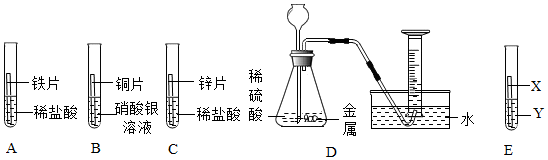
(3)A中锌能与硫酸铜反应,证明金属活动性锌>铜;B中铁能与硫酸铜反应,证明金属活动性铁>铜;C中锌能与盐酸反应,证明活动性锌>氢;D中铁能与盐酸反应,反应证明活动性铁>氢;E中铁不能与硫酸锌反应,证明金属活动性锌>铁;B证明了金属活动性铁>铜,E证明了金属活动性锌>铁,同时做B和E就可证明金属活动性锌>铁>铜。实验C中锌与盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑。
故答案为:
(1)SO3;
(2)质子数不同;
(3)BE;Zn+2HCl=ZnCl2+H2↑。
[点评]
本题考查了"金属活动性强弱的判断,元素的概念,周期表信息示意图及结构示意图的综合考查,",属于"难典题",熟悉题型是解题的关键。