服务热线
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| NaOH | 42.0g | 51.0g | 109.0g | 119g | 129g |
| KNO3 | 13.3g | 20.9g | 31.6g | 45.8g | 63.9g |
| Na2CO3 | 6.0g | 16.0g | 18.0g | 36.5g | 50.0g |

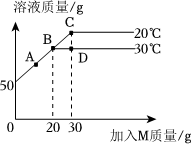 在不同温度时,向盛有50g水的烧杯中缓慢加入固体M,测得溶液质量与加入M质量的变化关系如图,回答下列问题:
在不同温度时,向盛有50g水的烧杯中缓慢加入固体M,测得溶液质量与加入M质量的变化关系如图,回答下列问题: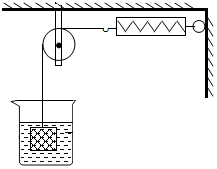 如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):
如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):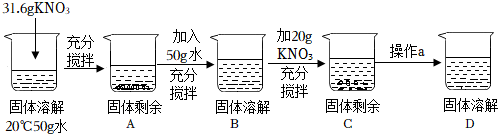
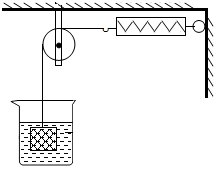 如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):
如图所示,物体悬挂在饱和的氯化钠溶液中,在恒温条件下向烧杯中分别加入下列物质(悬挂物不参加反应),说明弹簧秤读数的变化情况(填“变大”、“不变”或“变小”):| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | |
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | NaCl | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | |
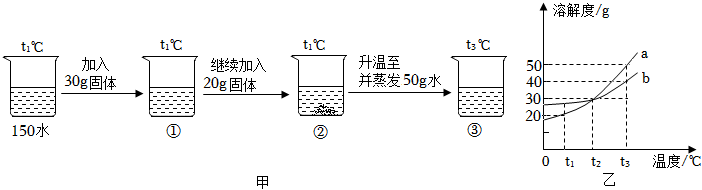
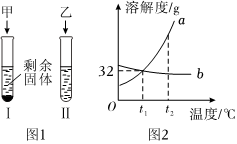 t2℃时,向分别盛有30mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,充分溶解并恢复原温后,观察到如图1所示的现象。图2是甲、乙两种固体的溶解度曲线,请回答:
t2℃时,向分别盛有30mL水的Ⅰ、Ⅱ两支试管中分别加入等质量的甲、乙两种固体,充分溶解并恢复原温后,观察到如图1所示的现象。图2是甲、乙两种固体的溶解度曲线,请回答:
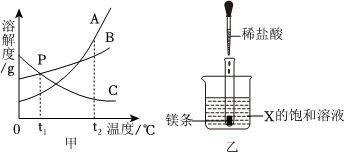

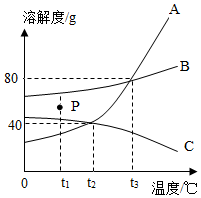 如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题:
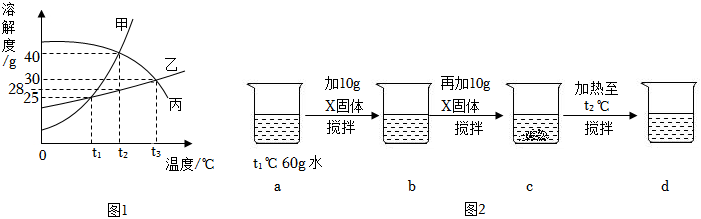
如图是A、B、C三种固体物质的溶解度曲线,请根据图示回答问题: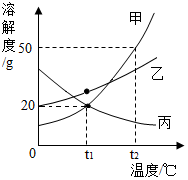 如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.
如图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.
dyczhxyn
2024-05-03
初中化学 | | 填空题