[解析]
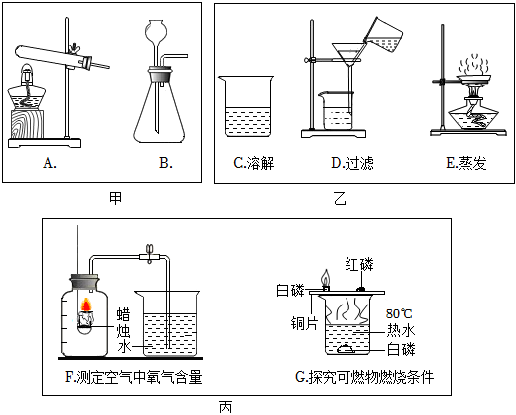
解:(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热反应的化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)乙组中过滤和蒸发中都要用到玻璃棒,所以均缺少的玻璃仪器是玻璃棒,在蒸发时未用玻璃棒搅拌造成的后果是:局部温度过高液滴迸溅。
(3)F是测定空气中氧气的体积分数,由于蜡烛燃烧生成了二氧化碳气体,不会形成压强差,不能测定出空气中氧气的体积分数,则则丙组中能达到实验目的的是G。若向装置G的水下白磷处通入氧气,白磷与氧气接触,温度达到了着火点,所以会观察到白磷燃烧。
故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)玻璃棒;局部温度过高液滴迸溅;
(3)G;白磷燃烧。