服务热线
搜题▪组卷
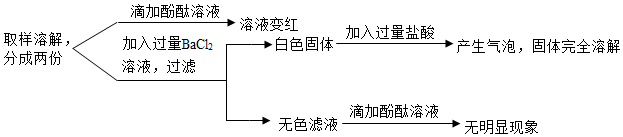
 A~G为实验室中未贴标签的7种溶液。已知7种溶液分别为:澄清的石灰水、氯化钠溶液、硫酸铜溶液、碳酸钠溶液、稀盐酸、氢氧化钠溶液和氢氧化钾溶液。
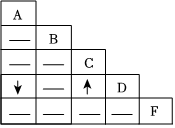
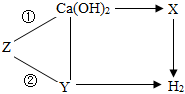
A~G为实验室中未贴标签的7种溶液。已知7种溶液分别为:澄清的石灰水、氯化钠溶液、硫酸铜溶液、碳酸钠溶液、稀盐酸、氢氧化钠溶液和氢氧化钾溶液。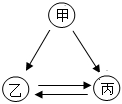 旅行可以让人放松心情,化学变化中,同种元素也可以在不同物质之间“旅行”。如图是初中化学中常见的三种物质之间的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),分析并回答问题:
旅行可以让人放松心情,化学变化中,同种元素也可以在不同物质之间“旅行”。如图是初中化学中常见的三种物质之间的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),分析并回答问题: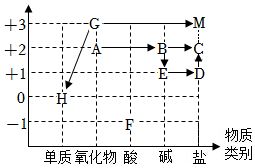 如图是依据物质类别和物质中元素的化合价构建的物质间的转化关系图(“→”表示物质间的转化),已知A~M等9种物质是由氢、碳、氧、氯、钠、钙、铁七种元素中的一种或几种组成的物质。
如图是依据物质类别和物质中元素的化合价构建的物质间的转化关系图(“→”表示物质间的转化),已知A~M等9种物质是由氢、碳、氧、氯、钠、钙、铁七种元素中的一种或几种组成的物质。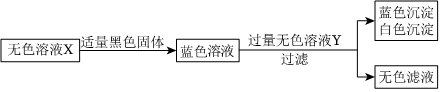
 如图所示的五种物质为初中化学常见的不同类别的物质,其中物质X是最常见的溶剂,物质Y和物质Z均由三种元素组成,其转化关系如图所示。“—”表示两端的物质可以发生反应,“→”表示一种物质可以转化为另一种物质。
如图所示的五种物质为初中化学常见的不同类别的物质,其中物质X是最常见的溶剂,物质Y和物质Z均由三种元素组成,其转化关系如图所示。“—”表示两端的物质可以发生反应,“→”表示一种物质可以转化为另一种物质。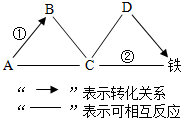 A、B、C、D分别为四种不同类别的化合物,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),B为大理石主要成分,C由两种元素组成。试推断并回答下列相关问题:
A、B、C、D分别为四种不同类别的化合物,它们之间的反应或转化关系如图所示(部分物质和反应条件已略去),B为大理石主要成分,C由两种元素组成。试推断并回答下列相关问题: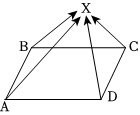
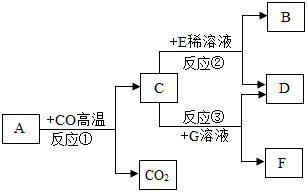
 处对应的一种物质与彩灯对应的四种物质均能发生反应,且现象不同,四盏彩灯同时亮起。分析
处对应的一种物质与彩灯对应的四种物质均能发生反应,且现象不同,四盏彩灯同时亮起。分析 处的物质是 。
处的物质是 。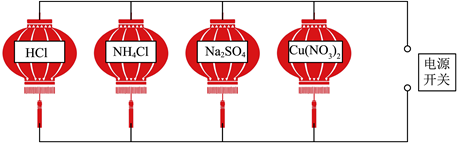
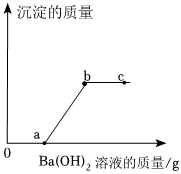 某溶液中溶质可能是HCl、Na2CO3、H2SO4、CuCl2中的一种或多种,为探究溶质的成分,兴趣小组的同学向盛有一定量样品的烧杯中逐滴加入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的变化趋势如图所示。
某溶液中溶质可能是HCl、Na2CO3、H2SO4、CuCl2中的一种或多种,为探究溶质的成分,兴趣小组的同学向盛有一定量样品的烧杯中逐滴加入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的变化趋势如图所示。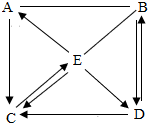 A-E是初中化学常见的物质,其中B是光合作用的原料、C是相对分子质量最小的氧化物,A、E物质类别相同且都属于碱,D是大理石的主要成分,D、B中含有相同的非金属元素。物质间的转化关系如图所示(“—”表示相邻两物质间能发生反应,“→”表示一种物质经一步反应装化为另一科物质,部分反应物、生成物及反应条件已略去)。请回答下列问题。
A-E是初中化学常见的物质,其中B是光合作用的原料、C是相对分子质量最小的氧化物,A、E物质类别相同且都属于碱,D是大理石的主要成分,D、B中含有相同的非金属元素。物质间的转化关系如图所示(“—”表示相邻两物质间能发生反应,“→”表示一种物质经一步反应装化为另一科物质,部分反应物、生成物及反应条件已略去)。请回答下列问题。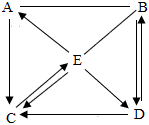 A-E是初中化学常见的物质,其中B是光合作用的原料、C是相对分子质量最小的氧化物,A、E物质类别相同且都属于碱,D是大理石的主要成分,D、B中含有相同的非金属元素。物质间的转化关系如图所示(“—”表示相邻两物质间能发生反应,“→”表示一种物质经一步反应装化为另一科物质,部分反应物、生成物及反应条件已略去)。请回答下列问题。
A-E是初中化学常见的物质,其中B是光合作用的原料、C是相对分子质量最小的氧化物,A、E物质类别相同且都属于碱,D是大理石的主要成分,D、B中含有相同的非金属元素。物质间的转化关系如图所示(“—”表示相邻两物质间能发生反应,“→”表示一种物质经一步反应装化为另一科物质,部分反应物、生成物及反应条件已略去)。请回答下列问题。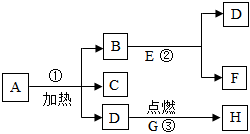 A、B、C、D、E、F、G、H八种物质,有如图所示关系,“→”表示可以向箭头所指方向转化,通常情况下E、F是一种无色液体,H是一种黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断:
A、B、C、D、E、F、G、H八种物质,有如图所示关系,“→”表示可以向箭头所指方向转化,通常情况下E、F是一种无色液体,H是一种黑色固体,在②的反应前后B的质量和化学性质都不改变.试推断:
sz@dyw.com
2025-03-07
初中化学 | | 填空题