服务热线
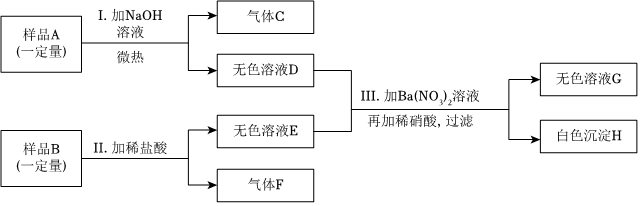
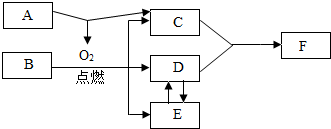
 A~D为初中化学常见物质,它们之间的转化关系如图(→指向生成物)。其中B为红色金属单质,D是最理想的清洁燃料。
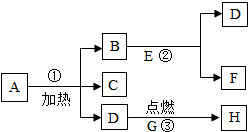
A~D为初中化学常见物质,它们之间的转化关系如图(→指向生成物)。其中B为红色金属单质,D是最理想的清洁燃料。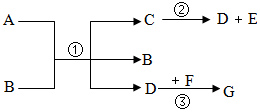 已知A~G都是初中化学常见的物质,通常状况下,A、C为无色液体,且组成元素相同,D、E为气体,它们之间的转化关系如图所示。回答下列问题:
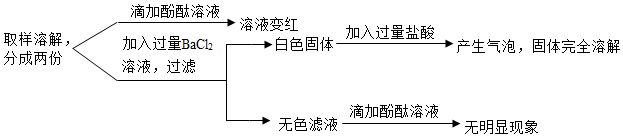
已知A~G都是初中化学常见的物质,通常状况下,A、C为无色液体,且组成元素相同,D、E为气体,它们之间的转化关系如图所示。回答下列问题: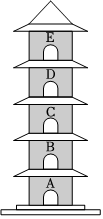 如图所示“延安”红色宝塔五层A~E分别代表初中化学中五种常见物质,下层物质可以生成相邻的上层物质,题中所涉及反应均为初中常见的化学反应。其中B常用于食品干燥剂且与水反应放热,A、B、C中含相同的金属元素。D俗称火碱。
如图所示“延安”红色宝塔五层A~E分别代表初中化学中五种常见物质,下层物质可以生成相邻的上层物质,题中所涉及反应均为初中常见的化学反应。其中B常用于食品干燥剂且与水反应放热,A、B、C中含相同的金属元素。D俗称火碱。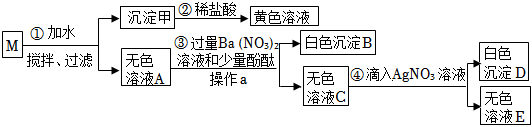
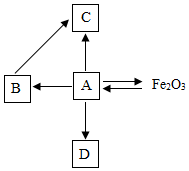
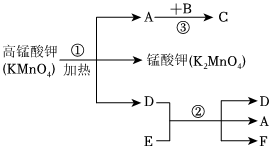
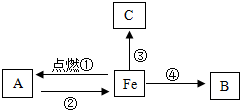 构建知识网络是一种重要的学习方法.如图是关于铁的化学性质知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.请回答下列问题:
构建知识网络是一种重要的学习方法.如图是关于铁的化学性质知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.请回答下列问题: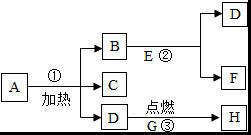
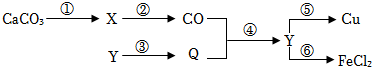
 已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。其中,只有A为单质,B和C含有的元素完全相同,D的物质类别不同于其他四种物质,E广泛用于玻璃、造纸、纺织和洗涤剂的生产,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答:
已知A、B、C、D、E是初中化学中常见的五种物质,均含有同一种元素。其中,只有A为单质,B和C含有的元素完全相同,D的物质类别不同于其他四种物质,E广泛用于玻璃、造纸、纺织和洗涤剂的生产,它们在一定条件下的转化关系如图所示(反应条件和部分反应物、生成物已省略),请回答: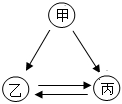 旅行可以让人放松心情,化学变化中,同种元素也可以在不同物质之间“旅行”。如图是初中化学中常见的三种物质之间的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),分析并回答问题:
旅行可以让人放松心情,化学变化中,同种元素也可以在不同物质之间“旅行”。如图是初中化学中常见的三种物质之间的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),分析并回答问题:
dyczhxyn
2025-03-16
初中化学 | | 填空题