[考点]
常用气体的发生装置和收集装置与选取方法,制取氧气的操作步骤和注意点,
[答案]
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)反应不需要加热,操作更简便(合理即可);
(3)④;
(4)①c;
②A。
[解析]
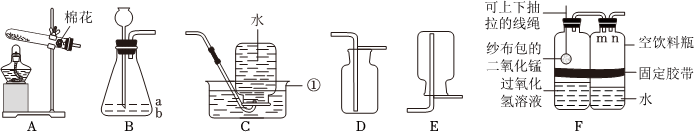
解:(1)实验室制取二氧化碳是用大理石(或石灰石,主要成分是碳酸钙)和稀盐酸反应,生成氯化钙、水和二氧化碳,化学反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
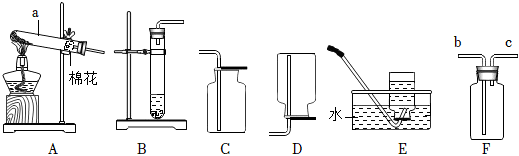
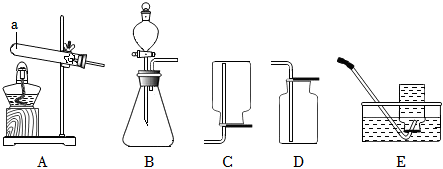
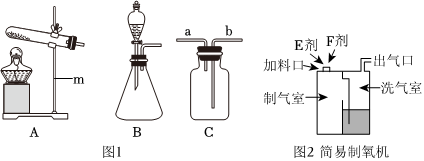
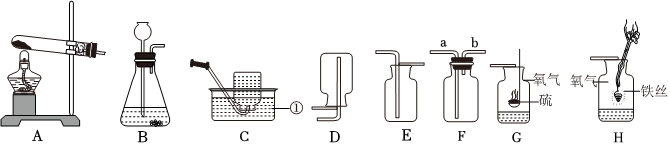
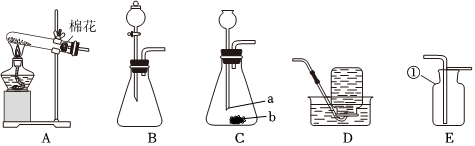
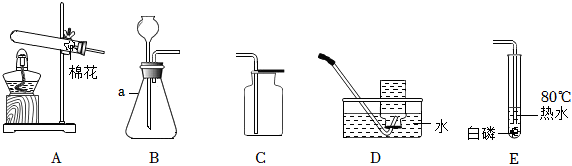
(2)A装置是固体加热型发生装置,B装置是固液常温型发生装置。实验室制取氧气时,用B装置比A装置的优点是:B装置反应不需要加热,操作更简便(或节约能源等,合理即可)。
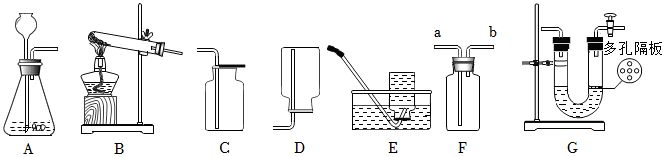
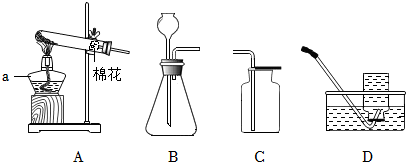
(3)①检查A装置气密性时,应先将导管放入水中,再双手紧握试管,观察导管口是否有气泡,不能先装试剂,因为装试剂后再检查气密性,若装置气密性不好,会浪费试剂,故①错误。
②实验室利用过氧化氢溶液和二氧化锰混合制氧气,反应物是液体和固体,反应条件是常温,发生装置可选B;氧气密度比空气大,可用向上排空气法收集,收集装置可选C,所以可选BC装置作为制取装置,故②错误。
③利用E装置(排水法)收集氧气时,导管口刚开始冒气泡不能立即收集,因为刚开始冒出的气泡是装置内的空气,应等到气泡连续均匀冒出时再收集,此时收集的氧气才纯净,故③错误。
④利用AE装置制取气体时,停止加热时,先把导管移出水面,然后再熄灭酒精灯,这样做是为了防止水槽中的水倒吸进入试管,使试管炸裂,故④正确。
故选:④。
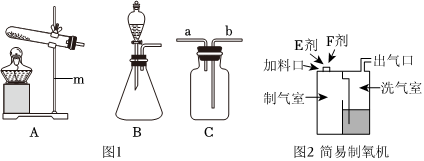
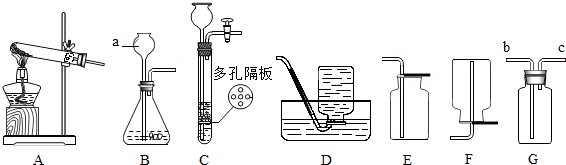
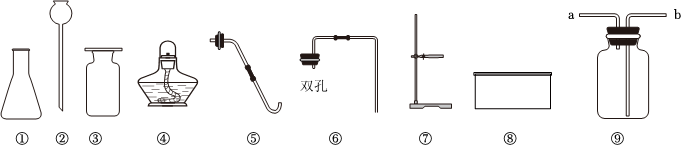
(4)①若用F装置排尽集气瓶中的空气收集CO2,因为二氧化碳密度比空气大,会沉在集气瓶底部,空气从上方排出,所以验满时燃着的木条应放在导管口c处,若木条熄灭,则证明二氧化碳已收集满。
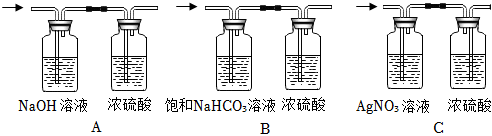
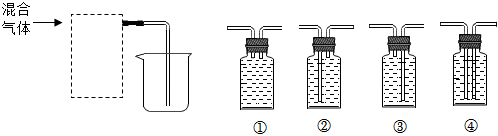
②要除去H2中混有的少量HCl和水蒸气,应先除氯化氢,再干燥。
A.NaOH溶液能吸收氯化氢,浓硫酸具有吸水性,不和氢气反应,能达到干燥的目的,故A正确;
B.饱和NaHCO3溶液能与氯化氢反应生成二氧化碳,引入了新杂质,故B错误;
C.AgNO3溶液能和氯化氢气体反应,把其除去,浓硫酸具有吸水性,不和氢气反应,但通过浓硫酸时应该长进短出,故C错误。
故选:A。
故答案为:
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)反应不需要加热,操作更简便(合理即可);
(3)④;
(4)①c;
②A。
[点评]
本题考查了"常用气体的发生装置和收集装置与选取方法,制取氧气的操作步骤和注意点,",属于"必考题",熟悉题型是解题的关键。

 ?
?