服务热线
搜题▪组卷
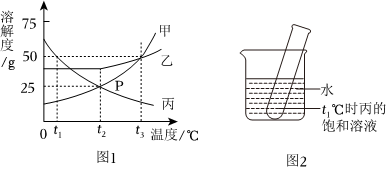
 如图是甲、乙两种物质的溶解度曲线,请结合图示回答问题:
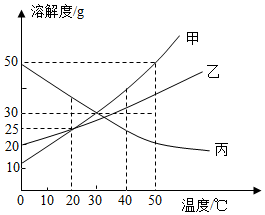
如图是甲、乙两种物质的溶解度曲线,请结合图示回答问题: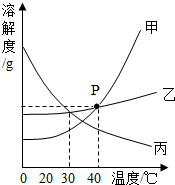 如图是甲、乙、丙三种固体物质的溶解度曲线,依据如图回答下列问题:
如图是甲、乙、丙三种固体物质的溶解度曲线,依据如图回答下列问题: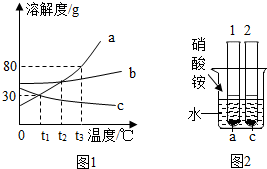

| 温度/℃ | 0 | 20 | 40 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | |
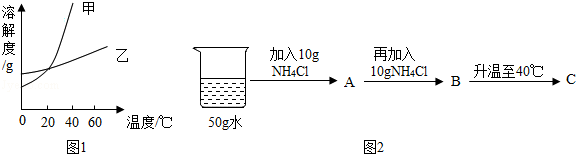
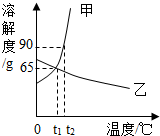
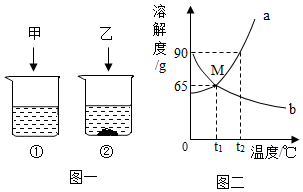 t2℃时,将甲、乙各80g分别放在盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题:
t2℃时,将甲、乙各80g分别放在盛有100g水的两个烧杯中,充分溶解后,恢复到t2℃,现象如图一,甲和乙的溶解度曲线如图二。请结合图示回答下列问题: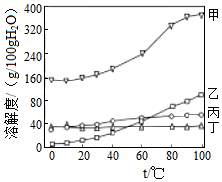 已知K2CrO7、KCl、NaCl、Na2CrO7四种物质的溶解度曲线甲、乙、丙、丁如图所示,但不知具体对应是哪条曲线。
已知K2CrO7、KCl、NaCl、Na2CrO7四种物质的溶解度曲线甲、乙、丙、丁如图所示,但不知具体对应是哪条曲线。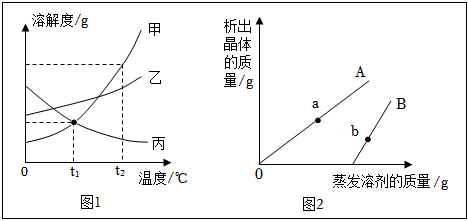
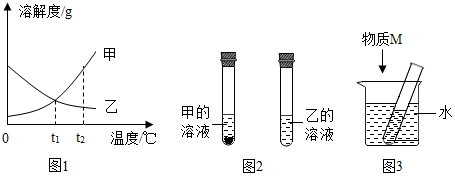
| 选项 | A | B | C | D |
| 试管内溶液中的溶质 | 甲 | 乙 | 甲 | 乙 |
| 物质M | NaOH | NaOH | NaCl | NH4NO3 |
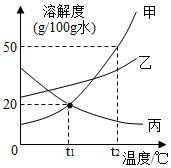 图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。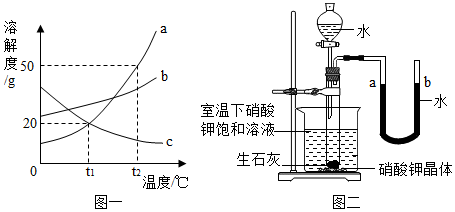
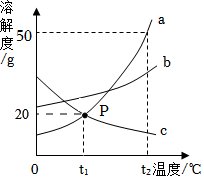 如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,回答下列问题。
如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,回答下列问题。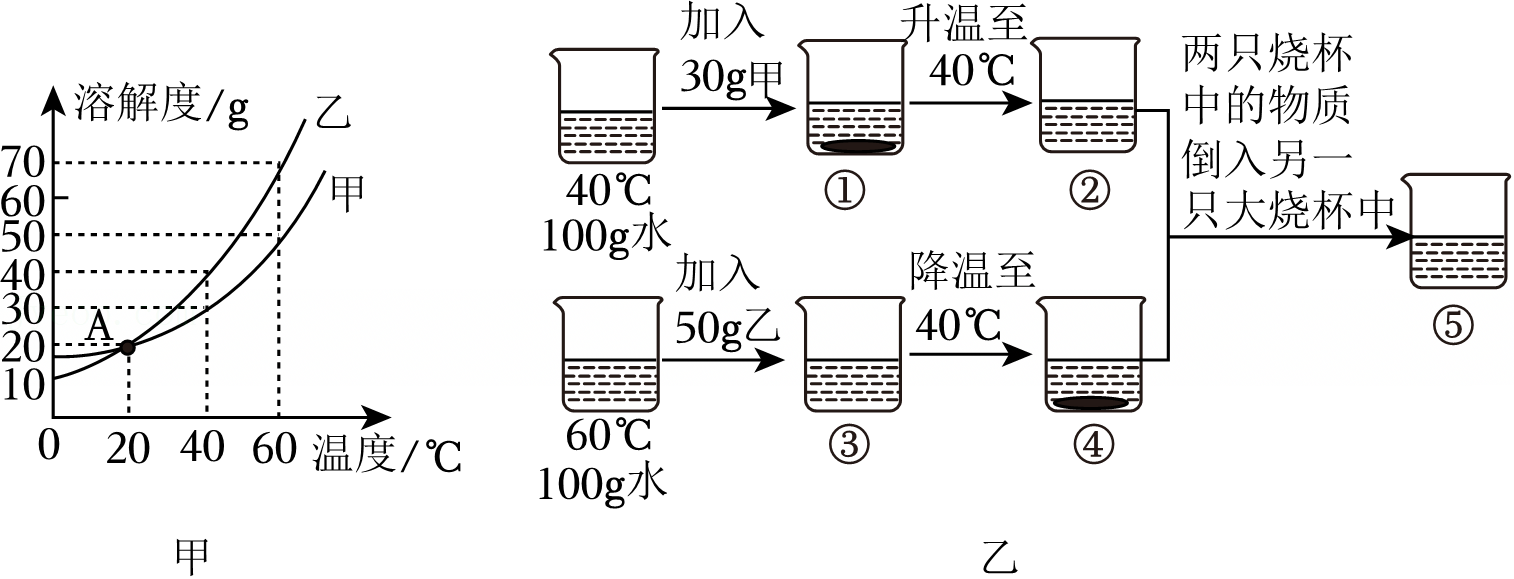

fzm@dyw.com
2025-03-07
初中化学 | | 填空题