服务热线
搜题▪组卷
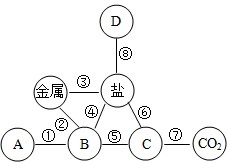
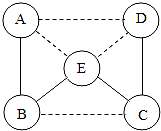 A-E是五种不同类别的常见物质:铁、二氧化碳、氢氧化钙、氯化铜、硫酸中的某一种,B常用于中和酸性土壤,E属于酸.他们之间的关系如图,(其中实线表示物质间可以相互反应,虚线表示物质间不能相互反应).请回答下列问题:
A-E是五种不同类别的常见物质:铁、二氧化碳、氢氧化钙、氯化铜、硫酸中的某一种,B常用于中和酸性土壤,E属于酸.他们之间的关系如图,(其中实线表示物质间可以相互反应,虚线表示物质间不能相互反应).请回答下列问题: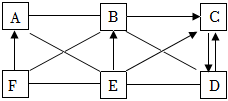 图中A~F为6种初中化学常见的物质,其中B是胃液的主要成分,C为一种常见溶剂,D可用于改良酸性土壤,F是一种红棕色的氧化物。各物质间的反应及转化关系如图所示(“—”表示两种物质间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应物、生成物、反应条件已略去)请回答:
图中A~F为6种初中化学常见的物质,其中B是胃液的主要成分,C为一种常见溶剂,D可用于改良酸性土壤,F是一种红棕色的氧化物。各物质间的反应及转化关系如图所示(“—”表示两种物质间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应物、生成物、反应条件已略去)请回答: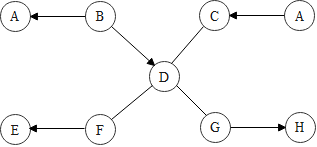
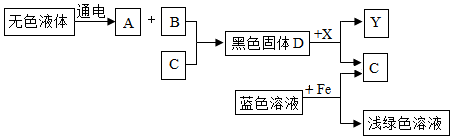
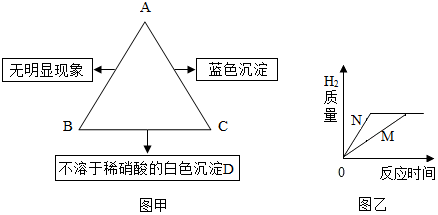
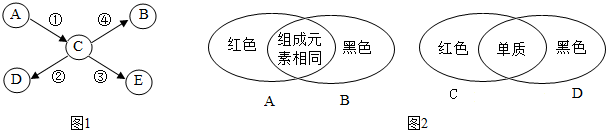
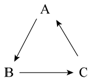 学习化学要善于总结物质之间的关系.A、B、C是初中化学常见物质,它们之间有如右图所示的转化关系(部分物质和反应条件已经略去,→表示生成).
学习化学要善于总结物质之间的关系.A、B、C是初中化学常见物质,它们之间有如右图所示的转化关系(部分物质和反应条件已经略去,→表示生成).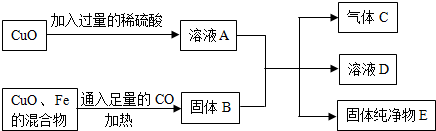
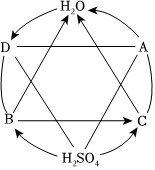 如图是初中化学几种常见物质之间的反应关系图。已知B和C的物质类别相同。A和D的反应可用于制取烧碱。H2O→D的反应会放出热量。图中“—”表示相连的两种物质能反应,“→”表示两端的物质通过一步反应能转化。
如图是初中化学几种常见物质之间的反应关系图。已知B和C的物质类别相同。A和D的反应可用于制取烧碱。H2O→D的反应会放出热量。图中“—”表示相连的两种物质能反应,“→”表示两端的物质通过一步反应能转化。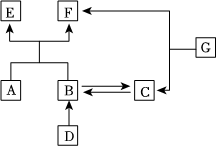 A~G是初中化学常见的物质,它们之间的转化关系如图所示(“→”表示反应能一步实现,部分物质和反应条件已略去)。F和G是组成元素相同的液体,C可使带火星的木条复燃,E是鸡蛋壳的主要成分,D是最清洁的化石燃料的主要成分。
A~G是初中化学常见的物质,它们之间的转化关系如图所示(“→”表示反应能一步实现,部分物质和反应条件已略去)。F和G是组成元素相同的液体,C可使带火星的木条复燃,E是鸡蛋壳的主要成分,D是最清洁的化石燃料的主要成分。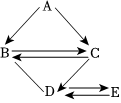

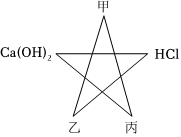 小丽学习酸、碱的知识后,构建了有关酸、碱与甲、乙、丙三种初中常见物质之间的反应关系图,图中连线两端的物质均能发生反应,其中甲为黑色固体单质,乙、丙为氧化物。请回答:
小丽学习酸、碱的知识后,构建了有关酸、碱与甲、乙、丙三种初中常见物质之间的反应关系图,图中连线两端的物质均能发生反应,其中甲为黑色固体单质,乙、丙为氧化物。请回答:
hu@dyw.com
2017-05-28
初中化学 | | 填空题